
 6CaSiO3+P4O10
6CaSiO3+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I-
C6H6O6+2H++2I- +I2
+I2 S4
S4 +2I-
+2I- +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O| | 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
 Ce(OH)4↓+ 。
Ce(OH)4↓+ 。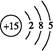
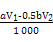 (或其他合理答案)
(或其他合理答案) 2Ce(OH)4↓+6H+
2Ce(OH)4↓+6H+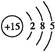 。
。 2Ce(OH)4↓+6H+。
2Ce(OH)4↓+6H+。

 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:不详 题型:单选题
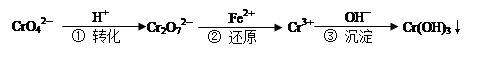
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2| A.反应①和②均为氧化还原反应 |
| B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.Na2Cr2O7中Cr元素的化合价为+7 |
| D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.24 mol | B.0.16 mol | C.0.21 mol | D.0.14 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 | 若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加 | |
 +3Mn
+3Mn +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为: )= ;FeC2O4的质量分数为 (精确到0.01%)。
)= ;FeC2O4的质量分数为 (精确到0.01%)。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.504 ml | B.336 ml | C.224 ml | D.168 ml |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH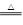 CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。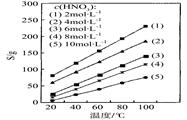
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
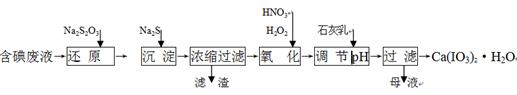
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com