
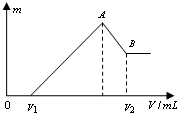
 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:分析 (1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=$\frac{n}{c}$计算;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有n(Na+)=2n(Na2SO4)=2(H2SO4)求出n(NaOH),再利用V=$\frac{n}{c}$计算;
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol•L-1硫酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,据此判断a的范围;
(4)V2mL时停止滴加NaOH溶液,此时溶质为偏铝酸钠,硫酸钠,开始往溶液中通入足量CO2,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,据此写出反应的离子方程式.
解答 解:(1)当V1=160mL时,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.16L×1mol/L=0.08mol,
设MgSO4为xmol,Al2(SO4)3为ymol,则:根据Mg原子、Al原子守恒有:x+2y=0.1,根据SO42-离子守恒有:x+3y=0.2-0.08,
联立方程解得:x=0.06、y=0.02,
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol,
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=$\frac{0.44mol}{1mol/L}$=0.44L=440mL,
故答案为:0.06,440;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=$\frac{0.4mol}{1molL}$=0.4L=400mL
故答案为:400;
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol•L-1硫酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,
故答案为:0.5≤a<1;
(4)V2mL时停止滴加NaOH溶液,此时氢氧化铝恰好完全溶解,溶液中溶质为硫酸钠和偏铝酸钠,若往溶液中通入足量CO2,偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-,
故答案为:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-.
点评 本题考查了有关混合物反应的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [NH4+]=[SO42-] | B. | [NH4+]>[SO42-] | ||
| C. | [NH4+]<[SO42-] | D. | [OH-]+[SO42-]=[H+]+[NH4+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.6% | B. | 42.4% | C. | 53.6% | D. | 46.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②④⑤①③ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、烧碱均属于碱 | B. | 氧化钠、过氧化钠属于碱性氧化物 | ||
| C. | 液氨、氨水属于混合物 | D. | 氧化铝属于两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液容易吸收空气中CO2变质而生成硅酸 | |
| B. | Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS | |
| C. | 实验室盛放NaOH溶液时不能使用玻璃塞,应该用橡胶塞 | |
| D. | 加碘食盐能使淀粉溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g氧气中所含的氧原子数为NA | |
| B. | 1molCl2与足量H2O反应,转移的电子数为2NA | |
| C. | 标准状况下,22.4L二氧化硅所含有的原子数目为3NA | |
| D. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH(aq) | B. | NaOH(aq) | C. | BaCl2(aq) | D. | Ba(OH)2(aq) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com