
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A、最高价氧化物对应水化物的碱性A>C |
| B、氢化物的沸点H2D>H2E |
| C、单质与稀盐酸反应的速率A<B |
| D、C2+与A+的核外电子数相等 |


科目:高中化学 来源: 题型:
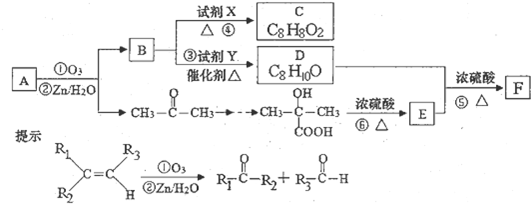
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5表面积大能吸附大量的有毒、有害物质 |
| B、PM2.5在空气中形成的分散系为胶体 |
| C、实施绿化工程,可以有效地防治PM2.5污染 |
| D、烟、雾属于胶体,能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族 |
| B、3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族 |
| C、最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6的离子,所对应的两元素一定在同一周期 |
| D、原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com