
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
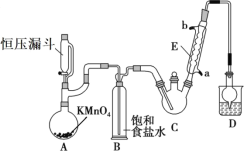
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
【答案】浓盐酸 圆底烧瓶 ![]() 无干燥装置 副产物增加 除去氯气中的氯化氢 否 三氯乙酸会溶于乙醇和三氯乙醛,无法分液 73.75%
无干燥装置 副产物增加 除去氯气中的氯化氢 否 三氯乙酸会溶于乙醇和三氯乙醛,无法分液 73.75%
【解析】
根据题干和装置图我们能看出这是一个有机合成实验题,考查的面比较综合,但是整体难度一般,按照实验题的解题思路去作答即可。
(1)根据反应原理我们发现原料需要氯气,因此装置A就应该是氯气的发生装置,所以恒压漏斗里装的是浓盐酸;盛放![]() 的装置是蒸馏烧瓶;
的装置是蒸馏烧瓶;
(2)按照要求来书写方程式即可,注意次氯酸的还原产物是氯化氢而不是氯气:![]() ;
;
(3)制得的氯气中带有氯化氢和水分,氯化氢可以在装置B中除去,但是缺少一个干燥装置来除去水分,若不除去水分,氯气和水反应得到次氯酸和盐酸,会生成更多的副产物;
(4)该方案是不行的,因为三氯乙酸是有机物,会溶于乙醇和三氯乙醛,根据题目给出的沸点可知此处用蒸馏的方法最适合;
(5)根据![]() 算出消耗的
算出消耗的![]() 的物质的量,根据2:1的系数比,这些
的物质的量,根据2:1的系数比,这些![]() 对应着过量的
对应着过量的![]() 单质碘,而一开始加入的碘的物质的量为
单质碘,而一开始加入的碘的物质的量为![]() ,因此整个过程中消耗了
,因此整个过程中消耗了![]() 单质碘,再次根据化学计量数之比发现
单质碘,再次根据化学计量数之比发现![]() :
:![]() 为1:1,也就是说产品中有
为1:1,也就是说产品中有![]() 三氯乙醛,质量为
三氯乙醛,质量为![]() ,因此产品的纯度为
,因此产品的纯度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】为了更简便地制取干燥的NH3,下列方法中适合的是
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱进行干燥
2NH3,用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3,气体用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( )
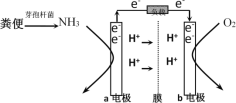
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写及评价合理的是( )
选项 | 离子方程式 | 评价 |
A |
| 正确, |
B |
| 正确, |
C | 将少量的 | 正确, |
D | 将 | 错误, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到足量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述错误的是
A. 当金属全部溶解时,电子转移的数目为0.3NA
B. 参加反应的金属的总质量3.6g<w<9.6g
C. 当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L
D. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积为l00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年因钢铁锈蚀造成了巨大的损失,下列有关说法不正确的是

A.钢铁腐蚀时化学能不能全部转化为电能
B.钢铁腐蚀的负极反应式为Fe-2e-=Fe2+
C.如图所示,将导线与金属锌相连可保护地下铁管
D.如图所示,将导线与外接电源的正极相连可保护地下铁管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌和纯铜按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
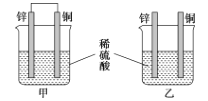
A.产生气泡的速率甲比乙快
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.两烧杯中铜片表面均有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________mol·L-1。(保留小数点后一位)
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A、容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
C、需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________mol·L-1。
②需用浓硫酸的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_______,提供孤电子对的成键原子是________。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com