
【题目】在体积为2L的恒容密闭容器中,充入2molCO2和6molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
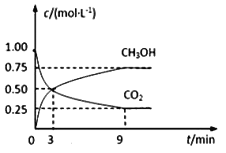
(1)0~9min内,v(H2)=__mol·L1·min1。
(2)能说明上述反应达到平衡状态的是__(填编号)。
a.反应中CO2与CH3OH的物质的量浓度之比为1:1
b.混合气体的密度不随时间的变化而变化
c.单位时间内消耗3 mol H2,同时生成1 mol H2O
d.CO2的体积分数在混合气体中保持不变
e.混合气体的压强不随时间的变化而变化
(3)平衡时H2的转化率为___。
(4)平衡时混合气体中H2O(g)的体积分数是__。
(5)一定温度下,第9分钟时v正(CH3OH)__(填“大于”、“小于”或“等于”)第3分钟时v逆 (CH3OH)。
【答案】0.25 de 75% 30% 大于
【解析】
(1)可先求出0~9min内v(CO2),然后利用速率之比等于化学计量数之比,求出v(H2)。
(2)a.反应中CO2与CH3OH的物质的量浓度之比为1:1,不能确定反应是否达平衡状态;
b.反应前后混合气的质量不变,体积不变,则混合气体的密度始终不变;
c.单位时间内消耗3 mol H2,同时生成1 mol H2O,此关系适合于反应进行中的任意阶段;
d.CO2的体积分数在混合气体中保持不变,表明反应达平衡状态;
e.平衡前,混合气体的压强随时间的变化而变化,只有平衡时压强才不发生改变。
(3)利用三段式,可求出H2的变化量,从而求出平衡时H2的转化率。
(4) 利用三段式,可求出H2O的变化量,也就是平衡量,从而求出平衡时混合气体中H2O(g)的体积分数。
(5)随着反应的进行,正反应速率不断减小,逆反应速率不断增大,但平衡前,正反应速率始终大于逆反应速率。
(1)0~9min内v(CO2)=![]() =
=![]() mol·L1·min1,v(H2)=3v(CO2)= 0.25mol·L1·min1。答案为:0.25;
mol·L1·min1,v(H2)=3v(CO2)= 0.25mol·L1·min1。答案为:0.25;
(2)a.反应中CO2与CH3OH的物质的量浓度之比为1:1,不能确定反应是否达平衡状态,a不合题意;
b.反应前后混合气的质量不变,体积不变,则混合气体的密度始终不变,所以密度不变时反应不一定达平衡状态,b不合题意;
c.单位时间内消耗3 mol H2,同时生成1 mol H2O,此关系适合于反应进行中的任意阶段,所以不一定达平衡状态,c不合题意;
d.CO2的体积分数在混合气体中保持不变,表明反应达平衡状态,d符合题意;
e.平衡前,混合气体的压强随时间的变化而变化,只有平衡时压强才不发生改变,e符合题意。答案为:de;
(3)
平衡时H2的转化率为![]() =75%。答案为:75%;
=75%。答案为:75%;
(4)平衡时混合气体中H2O(g)的体积分数为![]() =30%。答案为:30%;
=30%。答案为:30%;
(5)随着反应的进行,正反应速率不断减小,逆反应速率不断增大,但平衡前,正反应速率始终大于逆反应速率。由一定温度下,第9分钟时v正(CH3OH)大于第3分钟时v逆 (CH3OH)。答案为:大于。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】将标准状况下的HCl气体4.48 L溶于水形成100 mL溶液,然后与足量的铁屑充分反应。计算:
(1)所得盐酸溶液的物质的量浓度_______________
(2)参加反应的铁的质量____________
(3)生成的H2的体积(标况)___________
(4)将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成3种链状二肽
缩合最多可形成3种链状二肽
B.用酸性![]() 溶液可鉴别乙炔和乙醛
溶液可鉴别乙炔和乙醛
C.丙烯酸![]() 含有二种官能团,只能发生取代反应和加成反应
含有二种官能团,只能发生取代反应和加成反应
D.等质量的甲醛和乳酸![]() 完全燃烧消耗的氧气相等,生成水的质量也相等
完全燃烧消耗的氧气相等,生成水的质量也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)![]() xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
xC(g)+D(s),向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
A.平衡时甲中A的体积分数为0.4
B.平衡时甲、乙两容器中A、B的物质的量之比不相等
C.若平衡时两容器中的压强不相等,则两容器中压强之比为8:5
D.若平衡时甲、乙两容器中A的物质的量相等,则x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
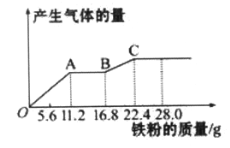
A. 第二份溶液中最终溶质为FeSO4
B. 原混合酸中NO3-物质的量为0.4mol
C. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
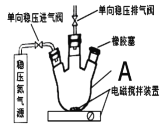
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-=2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-
Ⅱ.测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向A中加入200mL水样
c.向A中依次迅速加入1mLMnSO4无氧溶液(过量),2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向A中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从A中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol·L-1Na2S2O3溶液进行滴定,记录数据。
f.重复步骤e的操作2~3次
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器A的名称为___。
(2)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为___。
(3)配平反应②的方程式。___MnO(OH)2+___I-+___H+→___Mn2++___I2+___H2O
(4)步骤e中达到滴定终点的现象为___。
(5)若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=___mg/L(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
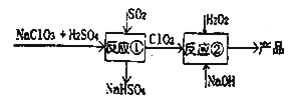
下列说法不正确的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为21
B.反应①氧化产物与还原产物的物质的量之比为1:1
C.反应②条件下,ClO2的氧化性大于H2O2反应
D.②中的H2O2可用NaClO4代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A.由图可知:乙酸的生成速率随温度升高而升高
B.250—300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C.由300—400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D.根据图像推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com