
【题目】(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。

(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。
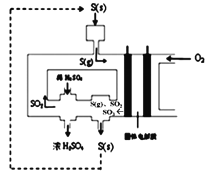
【答案】N2H4+4OH--4e-===N2+4H2O 2H2O-4e-===O2↑+4H+或4OH--4e-===2H2O+O2↑ 12.8 负 ClO- + 2e- + H2O = Cl-+ 2OH- S- 6e- +3O2- = SO3 硫磺(二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利于提高S转化率)
【解析】
(1)甲池为燃料电池,N2H4失电子生成氮气;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应;根据电路中每个电极得失电子守恒计算;
(2)原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此图示判断正负极,并书写电极反应式;
(3)根据图示,S转化为SO2和SO3,发生氧化反应,结合电解质为固体金属氧化物书写电极反应式;结合平衡移动原理分析提高转化率的方法。
(1)甲池为燃料电池,负极上发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2+4H2O;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应,反应式为4OH--4e-=2H2O+O2↑;甲池中每消耗0.1molN2H4,则根据负极N2H4-4e-+4OH-=N2+4H2O,转移0.4mol电子,所以乙池电极上则会析出![]() ×64g/mol=12.8g铜,故答案为:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
×64g/mol=12.8g铜,故答案为:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
(2)①燃料电池中,负极上燃料失电子发生氧化反应,化合价升高,正极上氧化剂得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为-1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,电极反应式为ClO-+2e-+H2O═Cl-+2OH-,故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
(3)根据图示,S转化为SO2和SO3,S元素的化合价升高,发生氧化反应,则S为负极,通氧气一端为正极,S(g)在负极生成SO2和SO3的电极反应式为S-4e-+2O2-=SO2、S-6e-+3O2-=SO3;若提高转化率,则平衡正向移动,所以可采取硫磺(二氧化硫)循环使用或用稀硫酸吸收三氧化硫,故答案为:S-6e-+3O2-=SO3;硫磺(二氧化硫)循环使用;用稀硫酸吸收三氧化硫。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O═4HF+O2D. 3NO2+H2O═2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是

A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amolX和bmolY的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确的是
2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amolX和bmolY的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确的是

A. 平衡时,X的体积分数:M<N
B. 若向N中再充入amolX和bmolY,则平衡时,X的转化率:M>N
C. 若a∶b=1∶3,当M中放出172.8kJ热量时,X的转化率为90%
D. 若a=1.2,b=1,并且N中达到平衡时体积为2L,此时含有0.4molZ,则再通入0.36molX时,υ(正)<υ(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:
CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。
CH4(g)+2O2(g) △H=+802kJ·mol-1。
将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________。

③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。
)与温度(T)的关系如图2所示。
①T0℃时,CO的体积分数最大的原因为_________________________________。
②若T0℃时,容器内起始压强为p0,CO的平衡体积分数为10%,则反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
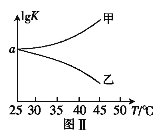
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 13∶8∶29B. 22∶1∶14
C. 29∶8∶13D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,Y、Z、W是原子序数递增的同周期相邻元素,且最外层电子数之和为15;X比Y核外少一个电子层;R的质子数是X、Y、Z、W四种元素质子数之和的![]() .下列说法正确的是( )
.下列说法正确的是( )
A. 简单离子半径:![]()
B. X与Y形成的二元化合物常温下一定为气态
C. W和R形成的化合物是离子化合物
D. Y与W、Z与W形成的二元化合物都是大气污染物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com