
分析 利用观察法配平方程式;根据方程式可知,每摩尔硝化甘油分解产生的气体,由此计算出0.1mol硝化甘油分解产生气体,根据已知,可求出生成1mol气体放出的热量,由此分析解答.
解答 解:配平方程式得:4C3H5N3O9$\frac{\underline{\;\;△\;\;}}{\;}$6N2+12CO2+O2+10H2O;硝化甘油的摩尔质量为227g/mol,
2.27g硝化甘油的物质的量为$\frac{2.27g}{227g/mol}$=0.01mol,生成气体$\frac{19}{4}$×0.01=0.0475mol,放出15.4KJ能量,
则生成1mol气体放出的热量为:$\frac{15.4KJ}{0.0475}$=324.2KJ,
故答案为:324.2.
点评 根据题中所给的信息,结合已经学习过的知识分析,本题考察信息问题的化学方程式的书写和能量的计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
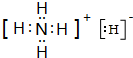 该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2
该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 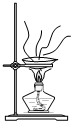 用装置蒸发、结晶制取粗盐 | B. | 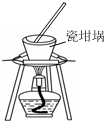 用装置加热熔融NaOH固体 | ||
| C. | 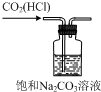 用装置除去CO2中的少量HCl | D. | 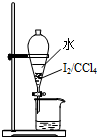 用装置进行萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO${\;}_{4}^{-}$+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH${\;}_{4}^{+}$+Al5++SO${\;}_{4}^{2-}$+Ba2++4OH-═BaSO4↓+Al(OH)5↓+NH5•H2O | |
| D. | 铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [N(CH3)4]+中只含共价键 | B. | 该反应中,SO2作氧化剂 | ||
| C. | SO2漂白品红是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.09mol | B. | 0.1 mol | C. | 0.2 mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
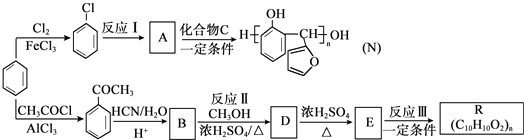

 .
. 生成
生成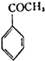 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂.
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com