
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 碳酸钙溶于稀盐酸中 CO32─+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3─+H+═CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
分析 A.澄清石灰水中氢氧化钙应拆成离子形式;
B.碳酸钙为沉淀,应保留化学式;
C.二者反应生成氯化钠、二氧化碳和水;
D.电荷不守恒.
解答 解:A.澄清的石灰水与稀盐酸反应,离子方程式:OH-+H+═H2O,故A 错误;
B.碳酸钙溶于稀盐酸中,离子方程式:Ca CO3+2H+═CO2↑+H2O+Ca2+,故B错误;
C.碳酸氢钠溶液与盐酸反应 HCO3─+H+═CO2↑+H2O,故C正确;
D.铜片插入硝酸银溶液中,离子方程式:Cu+2Ag+═Cu2++2Ag,故D错误;
故选:C.
点评 本题考查了离子方程式书写,侧重考查复分解反应、氧化还原反应离子方程式书写,熟悉反应实质,明确离子方程式书写方法是解题关键,注意离子反应遵循电荷守恒、原子个数守恒,题目难度不大.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| B. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA | |
| D. | 11.2 L标况下的SO3所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=v(NH3) | C. | 2v(N2)=v(NH3) | D. | v(N2)=3v(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
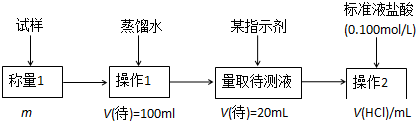
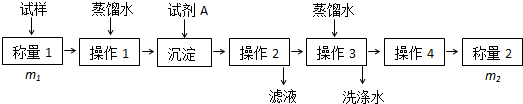
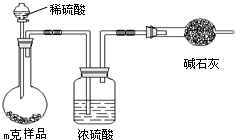
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
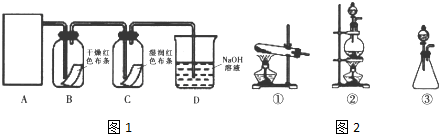
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通H2的一极是正极,通O2的一极是负极 | |
| B. | 通O2的一极是正极,通H2的一极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作时负极区附近pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体的相对分子质量比Y气体的相对分子质量大 | |
| B. | X可能是C2H4,Y可能是CH4 | |
| C. | X气体的密度小于Y气体的密度 | |
| D. | 充气后A气球质量比B气球质量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com