
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
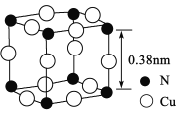
【答案】哑铃形或纺锤形 [Ar]3d10或1s22s22p63s23p63d10 sp3 (CH3)3N为极性分子,且可与水分子形成分子间氢键 V形 H2O或H2S 8 
【解析】
根据N原子的核外电子排布式判断最高能级的电子的电子云轮廓图。根据基态铜原子的核外电子排布式写出基态Cu+的核外电子排布式。根据价层电子对数判断杂化类型,根据分子结构判断易溶于水的原因。根据价层电子对互斥理论判断分子的立体构型,根据同族替换或等量代换找出等电子体。根据晶胞结构分析化学式并进行计算。
(1)N原子的核外电子排布式为1s22s22p3,最高能级的电子为2p上的电子,电子云轮廓图为哑铃形或纺锤形;基态铜原子的核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1,Cu+是基态铜原子失去最外层的一个电子得到的,Cu+的核外电子排布式为[Ar]3d10或1s22s22p63s23p63d10;
(2)化合物(CH3)3N分子中N原子与三个甲基形成了3对共用电子对,N上还有一对孤电子对,价层电子对数为4,杂化方式为sp3,(CH3)3N为极性分子,且可与水分子形成分子间氢键,故易溶于水;
(3)[H2F]+中F上的孤电子对数为![]() ,价层电子对数为2+2=4,VSEPR模型为四面体型,分子的空间构型为V形,与[H2F]+互为等电子体的分子为H2O或H2S;
,价层电子对数为2+2=4,VSEPR模型为四面体型,分子的空间构型为V形,与[H2F]+互为等电子体的分子为H2O或H2S;
(4)图中与每个Cu原子紧邻的Cu原子有8个,铜原子和氮原子的个数分别为![]() 、
、![]() ,该晶体的密度为
,该晶体的密度为 g/cm3。
g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
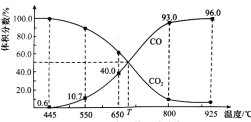
A. 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡不移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。

请回答∶
(1) C的化学式是______,组成A的三种元素是________。
(2) A加热分解的化学方程式是_____。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________。
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是_______。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______,(填“偏大”、“偏小”或“不变”),请说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3 mol O2加入V L的反应器中,在高温下放电,经t1 s 建立了平衡体系:3O2![]() 2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图像能正确表示气体的物质的量(n)跟时间(t)的关系的是
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土铈(Ce)元素主要存在于独居石中,金属铈化学性质十分活泼。近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<![]() <2,下列说法不正确的是
<2,下列说法不正确的是

A.CeO2是水分解的催化剂
B.T<1050℃时,CeO2比CeO2—δ稳定
C.工业上可用电解CeCl4溶液制备Ce
D.过程②的方程式为CeO 2—δ+δH2O![]() CeO2+δH2
CeO2+δH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
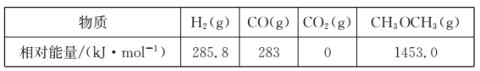
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
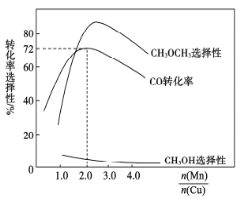
当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
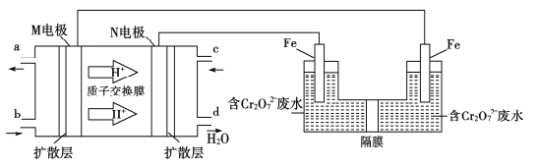
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电化学系统有两个研究方向。一是利用阳极室微生物降解有机废水,二是利用阴极还原能力处理含重金属废水。某文献报道,利用下图所示装置可使微生物和六价铬离子(Cr2O72—)不直接接触,处理高浓度含铬废水。装置工作时,下列说法错误的是( )
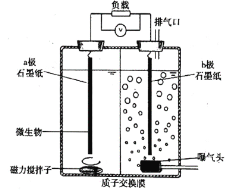
A.![]() 极附近
极附近![]() 增大
增大
B.该装置利用微生物产生电子和![]()
C.![]() 极石墨纸发生反应:
极石墨纸发生反应:![]()
D.利用该装置原理既能处理含铬废水,又能同步回收电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com