
【题目】下列哪一事实能说明生物界与非生物界具有统一性
A. 生物与非生物都具有化学变化
B. 生物与非生物都含有碳元素
C. 组成无机自然界的化学元素在生物体内都可以找到
D. 组成生物体的化学元素在无机自然界中都可以找到
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.1molCO2 的质量为44g/molB.CO2的摩尔质量为44g
C.CO2的摩尔质量等于CO2的相对分子质量D.NA个CO2的质量(以克为单位)与CO2的相对分子质量在数值上相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。

2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
(1)利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数KΘ=![]() ,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则KΘ=_____________(用含w的最简式表示)
②下图中可以示意标准平衡常数KΘ随温度T变化趋势的是_______。
 (3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由________________________。
②关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

(1)请写出“化学法”得到FeO42-的离子方程式___________________________。
(2)请写出阳极的电极反应式(含FeO42-)___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列说法不正确的是
,下列说法不正确的是
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸在一定条件下能发生取代反应
D. 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.蒸馏时,当烧瓶中液体出现暴沸时,要立即添加碎瓷片
B.在溶解、过滤、蒸发、萃取、分液等操作中均需使用玻璃棒
C.可以用铁丝代替铂丝进行焰色反应
D.用 pH 试纸测定新制氯水的 pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O![]() 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
2HCOOH+O2,装置如图所示,下列说法不正确的是( )

A. 电子由电极1经过负载流向电极2
B. 若将质子膜换成阴离子交换膜,该电池依然能够正常工作
C. 电极2的反应式:CO2+2H++2e﹣=HCOOH
D. 该装置能将太阳能转化为化学能和电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是重要的化工原料,可应用于冶金等领域,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_______________;
(2)现代开采金矿的流程如下:
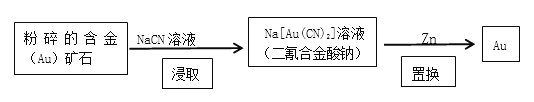
“粉碎”的目的是____________________;“浸取”反应的氧化剂是____________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂和方法除去各组物质中的少量杂质正确的是
A.甲苯中的苯酚(溴水、过滤)B.乙酸乙酯中的乙酸(NaOH溶液、分液)
C.乙醇中的乙酸(NaOH溶液、分液)D.乙醇中的水(新制的CaO、蒸馏)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸时,其中之一的反应是2SO2+O2![]() 2SO3,下列说法错误的是
2SO3,下列说法错误的是
A. 使用催化剂能显著增大反应速率
B. 压缩体积可提高反应速率
C. 达到化学平衡时,反应停止
D. 增大SO2的浓度可提高反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com