
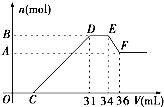
 硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )| A、合金与硝酸反应时硝酸过量 | B、合金中铝的物质的量为0.008mol | C、合金中金属的物质的量共为0.032mol | D、无法求出C点的值 |
| 0.012mol×8 |
| 3 |
| 0.032mol×3 |
| 4mol/L |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
(10分) 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铁粉和铝粉混合物与一定量很稀的硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入1 mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。(提示:氢氧化铝不溶于弱酸弱碱,只溶于强酸强碱)
(1) 铁与极稀的硝酸发生反应时得还原产物可能是____________;该反应的化学方程式为______________________________________________________________。
(2) B的数值是:______________mol。
(3) C的数值是:______________mL。
查看答案和解析>>
科目:高中化学 来源:2013届江西省丰城中学高三阶段测试化学试卷(带解析) 题型:计算题
(10分)硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合价越低。若硝酸现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。求:
(1)B与A的差值: mol;
(2)B的数值: mol;
(3)C的数值: mL。(要求有计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com