
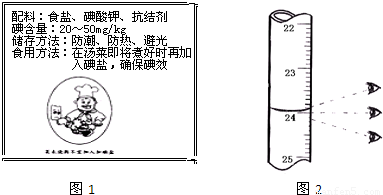
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 如图2 | ||
| 2 | 23.97 | 23.97 | |
| 3 | 24.03 | 24.03 | |
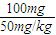 =2Kg,24小时内不可能服用2Kg碘盐,所以不合理,
=2Kg,24小时内不可能服用2Kg碘盐,所以不合理,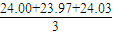 mL=24mL,消耗的硫代硫酸钠的物质的量是:n(Na2S2O3)=0.024L×bmol?L-1=0.024bmol,
mL=24mL,消耗的硫代硫酸钠的物质的量是:n(Na2S2O3)=0.024L×bmol?L-1=0.024bmol, n(Na2S2O3)=
n(Na2S2O3)= ×0.024bmol=0.004bmol,1Kg碘盐中碘含量是:
×0.024bmol=0.004bmol,1Kg碘盐中碘含量是: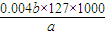 g/Kg=
g/Kg=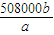 mg/kg,
mg/kg,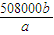 ;
; 

科目:高中化学 来源: 题型:阅读理解
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
| 508000b |
| a |
| 508000b |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州市高三上学期期末质量评估化学试卷 题型:填空题
天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式: ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢 加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
;
实验 二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,
二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量, 一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-: ;
一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-: ;
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式: ;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏 二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为 ;
二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为 ;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该 物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子
物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子 方程式: ;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱
方程式: ;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱 反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式: 。
反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com