
 氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:
氢化铝锂是有机合成中常见的强还原剂,合成LiAlH4的一种方法如下:分析 (1)LiH易与空气中的氧气发生反应;
(2)强烈搅拌是加快物质接触发生反应,液体的沸点,是指它的饱和蒸气压等于外界压力时的温度,因此液体的沸点是随外界压力的变化而变化的,如果借助于真空泵降低系统内压力,就可以降低液体的沸点,这便是减压蒸馏操作的理论依据,减压蒸馏目的是除去剩余乙醚;
(3)依据抽滤装置和步骤选择玻璃仪器;
(4)步骤Ⅱ合成反应是氯化铝和氢化锂在乙醇中反应生成四氢铝锂和氯化锂;
(5)红外光谱可用于研究分子的结构和化学键,也可以作为表征和鉴别化学物种的方法,红外光谱具有高度特征性,可以采用与标准化合物的红外光谱对比的方法来做分析鉴定固体成分和乙醚结构、化学键不同.
解答 解:(1)LiH易与空气中的氧气发生反应,步骤Ⅰ.需在N2气氛中粉碎LiH,其目的是防止LiH与O2反应着火燃烧,
故答案为:防止LiH与O2反应着火燃烧;
(2)强烈搅拌是加快物质接触发生反应,减压蒸馏目的是除去剩余乙醚,
故答案为:使反应物充分接触,除去残余的乙醚;
(3)依据抽滤装置和步骤选择硅酸盐质仪器即玻璃仪器为:布氏漏斗;吸滤瓶,
故答案为:布氏漏斗、吸滤瓶;
(4)步骤Ⅱ合成反应是氯化铝和氢化锂在乙醇中反应生成四氢铝锂和氯化锂,反应的化学方程式为:AlCl3+4LiH $\frac{\underline{\;乙醇\;}}{\;}$LiAlH4+3LiCl,
故答案为:AlCl3+4LiH $\frac{\underline{\;乙醇\;}}{\;}$LiAlH4+3LiCl;
(5)红外光谱可用于研究分子的结构和化学键,证明最后固体产物不含乙醚或不含乙醚合物所用的仪器分析方法是红外光谱分析,
故答案为:红外光谱分析.
点评 本题考查了物质的制备实验方案和设计,主要是实验过程分析,装置仪器的使用,掌握基础是解题关键,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
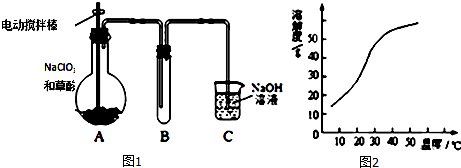
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |||
| C | D | |||
 ,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.
,其分子中共含有10个电子,A和D形成的常见化合物是由极性(填“极性”、“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
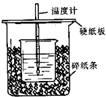 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等、密度不等的N2和C2H4 | B. | 等压等体积的N2和CO2 | ||
| C. | 等体积等密度的CO2和C2H4 | D. | 等温等体积的O2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法错误的是( )| A. | NH3和HCl分别形成蓝色、红色喷泉 | |
| B. | 制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸 | |
| C. | 改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同 | |
| D. | 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com