
向含有0.03 mol稀H2SO4和0.04 mol稀HNO3的混酸中加入1.92 g Cu,充分反应后得到无色气体(假设反应只有一种还原物),则收集到的气体在标准状况下的体积是多少?
解析: 在溶液中,与Cu反应的H+既有HNO3提供的,也有H2SO4提供的,即n(H+)=0.04 mol+0.03 mol×2=0.1 mol,而n(Cu)=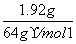 =0.03 mol。3Cu+8H++2NO
=0.03 mol。3Cu+8H++2NO ===3Cu2++2NO↑+4H2O,由方程式所确定的n (Cu)∶n (H+)=3∶8可知,H+过量,所以应按Cu来求NO的量。
===3Cu2++2NO↑+4H2O,由方程式所确定的n (Cu)∶n (H+)=3∶8可知,H+过量,所以应按Cu来求NO的量。
答案: 经分析知铜完全反应,应用铜计算NO的量。设得到NO的物质的量为x,则:
3Cu+8H++2NO ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
3 2
0.03 mol x
x=0.02 mol。所以VNO标=0.02 mol×22.4 L·mol-1=0.448 L。
即收集到的气体在标准状况下的体积为0.448 L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
搭载“神舟”七号的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后发生反应生成的气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红棕色烟,产生红棕色烟的主要原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.共价化合物中不可能含有离子键 B.有共价键的化合物,不一定是共价化合物
C.离子化合物中可能存在共价键 D.原子以极性键结合的分子,肯定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
A.B.C.D.E.F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;基态E原子p能级上有一对成对电子,C.F两种元素的原子最外层共有13个电子。回答下列问题:
(1)D.E.F中电负性最大的是 (填写元素符号)。
(2)写出D原子的外围电子排图为 。
(3)B.C.E分别与A形成的化合物中沸点最高的是 。
(4)C与D形成的化合物的化学式是 ,请写出其溶于NaOH的离子方程式 ;
(5)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊试液先变红后退色——酸性和强氧化性
B.不能用稀硝酸与锌反应制取氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色退去——强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,SO2表现氧化性的是( )
A.2SO2+O2 2SO3 B.SO2+H2OH2SO3
2SO3 B.SO2+H2OH2SO3
C.2H2S+SO2===3S↓+2H2O D.SO2+2H2O+Cl2===H2SO4+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
将浓硫酸和2 mol/L的硫酸在实验室中敞口放置。它们的质量和放置天数的关系如下图所示。分析a、b曲线变化的原因是( )
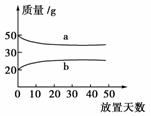
A.a升华、b冷凝 B.a蒸发、b吸水
C.a蒸发、b潮解 D.a冷凝、b吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究是体验知识产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需要用到的仪器是________________________________;
(2)CCl4在实验中所起的作用是______________________________;
(3)在实验②中四氯化碳层颜色变化过程为________________________ ________________________________________________;
(4)该同学的实验缺陷是_______________________________________________,
改进的办法是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO +4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
+4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com