
在0.1mol•L﹣1 CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO﹣+H+,对于该平衡,下列叙述正确的是( )
|
| A. | 加入水时,平衡向逆反应方向移动 |
|
| B. | 加入少量NaOH固体,平衡向正反应方向移动 |
|
| C. | 加入少量0.1mol•L﹣1 HCl溶液,溶液中c(H+)减小 |
|
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
考点:
弱电解质在水溶液中的电离平衡.
专题:
电离平衡与溶液的pH专题.
分析:
A、稀释弱电解质溶液,会促进电离;
B、H+被氢氧化钠消耗,平衡向着正向移动;
C、引进了氢离子,平衡向着逆向移动,但是c(H+)会增大;
D、加入醋酸根离子,平衡向着逆向移动.
解答:
解:A、加入水时,溶液被稀释,电离平衡向着正向移动,会促进醋酸的电离,故A错误;
B、加入少量NaOH固体后,H+和氢氧化钠反应,平衡向着正向移动,故B正确;
C、盐酸是强电解质,加入后溶液中c(H+)增大,电离平衡向着逆向移动,但是达到新的平衡时,溶液中c(H+)增大,故C错误;
D、加入少量CH3COONa固体,溶液的c(CH3COO﹣)增大,平衡向着逆向移动,故D错误.
故选B.
点评:
本题考查的是影响弱电解质电离平衡的因素,如温度、浓度等,难度适中.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
分离苯和苯酚的混合物,通常采用的方法是( )
|
| A. | 加水振荡后,用分液漏斗分离 |
|
| B. | 加稀盐酸振荡后,用分液漏斗分离 |
|
| C. | 加入浓溴水振荡后过滤 |
|
| D. | 加NaOH溶液振荡后,用分液漏斗分离,取下层液体通入CO2或加入适量盐酸后,再用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸.恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
|
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H1=△H2=△H3 | D. | △H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | pH=7的溶液一定显中性 |
|
| B. | pH=6的溶液一定显酸性 |
|
| C. | c(H+)<c(OH﹣)的溶液一定显碱性 |
|
| D. | c(OH﹣)=1×10﹣6 mol/L的溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为 ;
(2)反应是 反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(CH2)=c(CO)•c(H2O),试判断此时的温度为 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠二水合物Na2Cr2O7·2H2O广泛用作氧化剂、金属表面精整、皮革制作等。以铬矿石(Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:
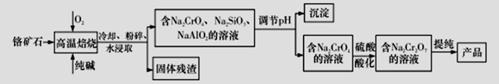
请回答下列问题:
(1)写出Cr2O3在高温焙烧生成Na2CrO4的化学方程式__________________________。
(2)调节pH后得到的沉淀主要是____________(填写化学式).
(3)写出用硫酸酸化使Na2CrO4转化为Na2Cr2O7的原理(写出离子方程式并加以文字说明):__________。
(4)氯化铬酸CrO2Cl2是红色液体,它可由Na2Cr2O7与NaCl的固体混合物和浓硫酸小心加热下制得,写出制备CrO2Cl2的化学反应方程式____________________________。
(5)某化工厂采用石墨作电极电解Na2CrO4溶液,实现Na2CrO4转化为Na2Cr2O7的生产,其原理如图所示。

①通电后阳极区溶液的颜色变化为__________________________________。
②写出电解Na2CrO4溶液制备Na2Cr2O7的化学反应方程式:_______________________________。
③在电流为I A.通电时间为t s后,两极共收集到3.36 L气体(标准状况下),则阿伏加德罗常数的表达式NA =_____mol-1(己知电子的电量为1.6* 10-19C)。
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的O2的质量,单位:mg·L-1),现有某水样200.00 mL,酸化后加入c1 mol/L的Na2Cr2O7溶液V1 mL,使水中的还原性物质完全被氧化(还原产物为Cr3+ );再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。则该水样的COD为_____________mg·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
.短周期元素W 、X、 Y、 Z的原子序数依次增大,且W 、X、 Y+、 Z的最外层电子数与其电子层数的比值依次为2 、3、 4、 2(不考虑零族元素)。下列关于这些元素的叙述错误的是 ( )
A.X和其他三种元素均可形成至少2种二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W 、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是()
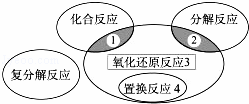
A. 2H2+O2 2H2O
2H2O
B. 2NaHCO3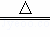 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C. CuO+CO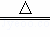 Cu+CO2
Cu+CO2
D. Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com