
【题目】称取(NH4)2SO4和NH4HSO4混合物样品7.58g,加入含0.1mol NaOH的溶液,加热充分反应,生成NH3 1792mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
科目:高中化学 来源: 题型:
【题目】在食品中的一些元素含量偏高会引起毒性反应,食品卫生法对它们的含量最高标准有极严格规定,这些元素是
①Na ②Mg ③As砷 ④Cd镉 ⑤Ca ⑥Zn ⑦Hg ⑧Pb ⑨Cu ⑩K中的
A.②④⑥⑦⑧ B.②④⑥⑧⑨
C.⑥⑦⑧⑨⑩ D.③④⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水等进行有效检测与合理处理。某工厂处理含+6价铬的污 水工艺的流程如下:

(1)请写出N2H4的电子式____________________。
(2)下列溶液中,可以代替上述流程中N2H4的是______________(填选项序号)。
A. FeSO4溶液 B.浓硝酸 C.酸性KMnO4溶液 D. Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为________________。
(4)Cr(OH)3的化学性质与A1(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示为_______________________________。
(5)实际工业生产中,有时还可采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子(此时氢离子不参与交换)。常温下,将pH=5的废水经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为___________________________。
(6)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①己知含铬废水中存在着平衡,Cr2O72-和CrO42-在溶液中可相互转化,请用离子方程式表示它们之间的转化反应____________________________。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种.若将纳米碳均匀地分散到蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀( )
A.①④⑥
B.②③④
C.②③⑤
D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的( )
A. NaHSO4Na++H++SO42-
B. NaHCO3═Na++H++CO32-
C. HClO ═ H++ClO-
D. H2S H++HS- , HS- H++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一银针验毒的记载,“银针验毒”的原理是4Ag + 2H2S + O2 =" 2X" + 2H2O,下列说法正确的是
A. X的化学式为AgS B. 银针验毒时,空气中氧气失去电子
C. 反应中Ag和H2S均是还原剂 D. 每生成1mo1X,反应转移2mo1e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是 ( )
A. 乙醇与浓硫酸共热至170 ℃;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 乙醇与浓硫酸加热到140 ℃;由丙烯加溴制1,2-二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;溴乙烷与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体G的合成路线如下:
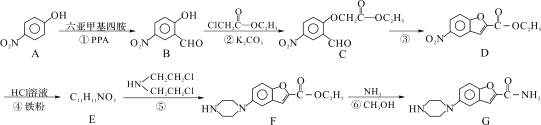
已知:![]()
请回答下列问题:
(1)C中含氧官能团的名称_________。(任写两种)
(2)反应④的反应类型是:_________,G的分子式为:_________。
(3)下列有关说法错误的是_________。
a.B遇FeCl3溶液显紫色且能发生银镜反应
b.A、B两种物质不可用核磁共振氢谱或红外光谱区别
c.C能发生取代、加成、氧化、还原反应
d.1 mol D能与2 mol NaOH反应
(4)反应②的化学方程式:_________;反应②加入K2CO3的作用是_________。
(5)写出同时满足下列条件B的一种同分异构体的结构简式:_________。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应
③核磁共振氢谱有三组峰
(6)已知:![]()
请以甲苯、乙醇等为原料制备 ![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见题干)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O![]() H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+![]() I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com