
【题目】下列水解化学方程式或水解离子方程式正确的是: ( )
A. CH3COO— + H2O![]() CH3COOH + OH— B. NH4+ + H2O=NH4OH + H+
CH3COOH + OH— B. NH4+ + H2O=NH4OH + H+
C. CH3COOH + NaOH![]() CH3COONa + H2O D. NaCl + H2O
CH3COONa + H2O D. NaCl + H2O![]() NaOH + HCl
NaOH + HCl
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
___与盐酸反应最剧烈;____与盐酸反应的速度最慢;___与盐酸反应产生的气体最多。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH碱性强于NH3·H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由____。
II. 利用如图装置可验证同主族元素非金属性的变化规律。
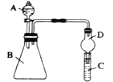
(3)仪器B的名称为____,干燥管D的作用为___。
(4)若要证明非金属性Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(5)若要证明非金属性C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液____(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_____溶液的洗气瓶除去。正交硫转化为单斜硫时,发生_____(填“物理变化”或“化学变化”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:

(1)元素①可与18O组成多种水分子,其相对分子质量的最大值为_____;元素①可与元素②形成一种由五个原子构成的+1价阳离子,该离子所含电子数为____________;
(2)判断:已知元素④的非金属性比⑧强,故④的单质可以从⑧的可溶性盐溶液中置换出⑧的单质___。(填“正确”或“错误”)。
(3)元素⑤⑦的最高价氧化物的水化物发生反应的化学方程式为_________;
(4)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
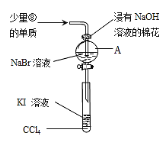
①A中发生的反应的离子方程式是_______;
②棉花中浸有的NaOH溶液的作用是_______;
③VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,____,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素及其化合物的转化关系中,A、B、C、D为单质,甲、乙、丙、丁、戊为化合物;A、甲、乙、丁的焰色均为黄色;B是最轻的气体,B与C反应生成丙。请回答下列问题:

(1)甲、丁的化学式分别是 __________________、____________________。
(2)甲+丙的化学反应方程式_____________________________________________。
(3)乙+D的离子方程式________________________________________________。
(4)戊生成AlCl3的离子方程式________________________________________。
(5)元素E是地壳中含量第二位的金属元素,写出单质E与水的反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的说法中,不正确的是
A.SO2不能用来漂白食品
B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4
D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
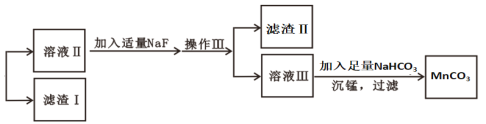
【题目】某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。(填化学式)
(5)沉锰的化学方程式为_________________________________________。
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com