
 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+. 科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/°C | 沸点/°C | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉和食盐的混合物 | B. | 石灰石与泥沙的混合物 | ||
| C. | 碘与酒精的混合物 | D. | 泥沙与氯化钠的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. | 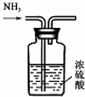 用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 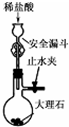 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | ③和④ | D. | ①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径介于1--10nm之间的粒子称为胶体 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 氢氧化铁胶体是纯净物 | |
| D. | 可以通过过滤的方法分离胶体和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com