
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
分析 (1)依据图表中物质物质的量随时间变化而不变,判断反应达到的平衡状态;
(2)依据第5min时物质的物质的量变化分析二氧化硫和氧气物质的量减小,三氧化硫物质的量增加,平衡正向进行;
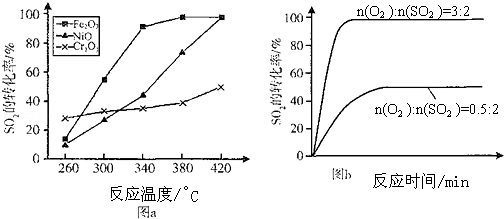
(3)根据图示内容对比260℃时SO2的转化率来寻找反应速率最快,根据催化剂和二氧化硫转化率之间的关系来判断Fe2O3作催化剂的优点;
(4)分析图象b知,当SO2的物质的量相同时,O2的物质的量越大,达平衡的时间越短,反应速率越快,SO2的平衡转化率越大,以此可画出n(O2):n(SO2)=1:2时SO2转化率的预期变化曲线.
解答 解:(1)图表数据分析可知在3~4min和7~9min时,二氧化硫、氧气和三氧化硫物质的量不变说明反应达到平衡,故答案为:3~4min、7~9min;
(2)第5min时物质的物质的量变化分析二氧化硫和氧气物质的量减小,三氧化硫物质的量增加,平衡正向进行,依据平衡移动原理分析可知增大压强平衡正向进行,符合物质的量变化,
故答案为:增大压强;正;
(3)根据图示内容,对比260℃时不同催化剂作用下SO2的转化率,可以看出Cr2O3作催化剂时,反应速率最快,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,但是Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,故答案为:Cr2O3;Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率;
(4)分析图象b知,当SO2的物质的量相同时,O2的物质的量越大,达平衡的时间越短,反应速率越快,SO2的平衡转化率越大,以此可画出n(O2):n(SO2)=1:2时SO2转化率的变化曲线应该接近n(O2):n(SO2)=3:2,而且反应所用时间较0.5:2时要短,即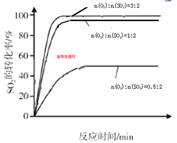 ,
,
故答案为: .
.
点评 本题考查了影响反应速率和化学平衡的因素,侧重于催化剂的影响考查,注意对图象的分析应用,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 晶体硅制作的光导纤维遇强碱会“断路” | |
| B. | 煤的综合利用主要是通过煤的干馏、液化和气化以获得洁净的燃料和多种化工原料 | |
| C. | 氢气燃烧能放出大量的热量,燃烧产物是水,所以是理想的清洁燃料 | |
| D. | 化学电源有一次电池和二次电池之分,一次电池用过之后不能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
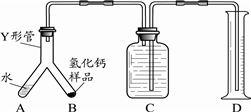
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
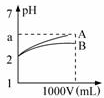 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )| A. | a=5时,A是强酸,B是弱酸 | |
| B. | 若A、B都是强酸,则5>a>2 | |
| C. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| D. | A、B两种酸溶液的物质的量浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外电子层上有7个电子 | D. | 砹能从NaCl溶液中置换出氯单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com