
| A. |  | B. |  | ||
| C. |  | D. |  |
分析 原子的核外电子排布符合基态原子核外电子填充的能级顺序和能量最低原理、泡利不相容原理及洪特规则,原子处于基态,否则为激发态,以此进行判断.
解答 解:A、根据泡利原理同时考虑洪特规,则氧元素基态原子的电子排布图书写为 ,故A错误;
,故A错误;
B、N原子核外有7个电子,分别位于1S、2S、2P轨道,则氮元素基态原子的电子排布图书写为 ,故B错误;
,故B错误;
C、根据洪特规则:在相同能量的轨道上,电子在排布的时候优先进入空轨道,每个轨道中的单电子取得相同自旋,则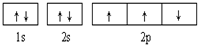 违背了洪特规则,故C错误;
违背了洪特规则,故C错误;
D、符合基态原子核外电子填充的能级顺序和能量最低原理、泡利不相容原理及洪特规则,原子处于基态,故D正确,
故选D.
点评 本题考查了电子排布图,注意把握泡利原理和洪特规则的内容,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 正反应速率先增大后减小 | B. | 逆反应速率先增大后减小 | ||
| C. | 容器内温度降低 | D. | 某反应物的体积百分含量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液(CaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | KNO3溶液(KCl):加过量AgNO3溶液,过滤 | |
| C. | NaCl溶液(Br2):加汽油,分液 | |
| D. | NaHCO3溶液(Na2CO3):通入足量的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O可以溶于冷水,MgO也可以溶于冷水 | |
| B. | Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解 | |
| C. | CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2 | |
| D. | Fe与Cl2反应生成FeCl3,则Fe可与I2反应生成FeI3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸 | |
| B. | ②中海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 在第③④⑤步中溴元素均被氧化 | |
| D. | 第⑤步涉及的分离操作有萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr下列关于此电池说法正确的是( )| A. | 放电过程中钠离子从左到右通过离子交换膜 | |
| B. | 电池充电时,阴极反应为:3NaBr+2e-=NaBr3+2Na+ | |
| C. | 电池中右侧的电解质溶液为Na2S2-Na2S4混合溶液 | |
| D. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种可连续使用的锂电池结构如图所示.下列有关该电池放电时的说法不正确的是( )
一种可连续使用的锂电池结构如图所示.下列有关该电池放电时的说法不正确的是( )| A. | Li+从锂极区向Ti极区迁 | |
| B. | 钛极上发生的电极反应为Li++e-═Li | |
| C. | 电子由Li电极经外电路移向Ti电极 | |
| D. | 贮罐中发生的离子反应为S2O82-+2Fe2+═2Fe3++2SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:Fe+2H+═3Fe2++H2↑ | |
| B. | 硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 实验室制取二氧化碳:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液和稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com