
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ��

��1������A���ʾ25 ��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�����100 ��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬��100 ��ʱ��ˮ�����ӻ�Ϊ______________��
��2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£���ʹ�����ҺpH��7����Ba(OH)2������������Ϊ_______________________��
��3��25 ��ʱ����ˮ�м�������̼���ƹ��壬�õ�pHΪ11����Һ����ˮ������ӷ���ʽΪ_________________________����ˮ�������c(OH��)��_______________mol��L��1��
��4���������������Һ�У������ӵ������ʵ���������_____________(�����)��
��0.1 mol��L��1��CuSO4��Һ ��0.1 mol��L��1��Na2CO3
��0.1 mol��L��1��KCl ��0.1 mol��L��1��NaHCO3
��5��ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2A===H����HA����HA��H����A2����
����Na2A��Һ��__________(����ԡ������ԡ����ԡ�)��NaHA��Һ��__________(����ԡ������ԡ����ԡ�)��
������0.1 mol��L��1 Na2A����Һ�����и�����Ũ�ȹ�ϵ��ȷ����__________(����ĸ)��
A��c(Na��)>c(A2��)>c(OH��)>c(HA��)
B��c(Na��)=2c(HA��)+2c((A2��)+2c(H2A)
C��c(Na��)+c(H��)=c(HA��)+c(A2��)+c(OH��)
D��c(OH��)=c(HA��)+c(H��)
���𰸡�10��12 2��9 CO32-��H2OHCO��OH����HCO��H2OH2CO3��OH�� 10��3 �� ���� ���� AD
��������
��1��KW=c��H+����c��OH-������2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£�ʹ�����ҺpH��7����ʱ��Һ�ʼ���������![]() ����Ba(OH)2����������������3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣻ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ���4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-
����Ba(OH)2����������������3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣻ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ���4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-
����ˮ�⣬��ˮ��̶�CO32->HCO3-����5����HA��H����A2�����棬����A2-ˮ�⣻H2A===H����HA�������棬HA��ֻ���벻ˮ�⣻��Na2A����Һ����A2��+H2OHA��+ OH-��H2OH++OH-����ƽ�⣻H2A��һ��������ȫ����Һ��û��H2A������c(Na��)+c(H��)=c(HA��)+c(A2��)+c(OH��)�����ϵ���غ��� c(OH��)=c(HA��)+c(H��)���������غ���
��1��KW=c��H+����c��OH-��������100 ��ʱ��ˮ�����ӻ�Ϊ=![]() ����2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£�ʹ�����ҺpH��7����ʱ��Һ�ʼ�����
����2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£�ʹ�����ҺpH��7����ʱ��Һ�ʼ�����![]() ��
��![]() �����
�����![]() 2��9�� ��3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣬ˮ�����ӷ���ʽ��CO32-��H2OHCO��OH����HCO��H2OH2CO3��OH����ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ�����ˮ�������c(OH��)��10��3mol��L��1����4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-����ˮ�⣬��ˮ��̶�CO32->HCO3-����������������������0.1 mol��L��1��Na2CO3��ѡ�ڣ���5����HA��H����A2�����棬����A2-ˮ�⣬Na2A��Һ�Լ�����H2A===H����HA�������棬HA��ֻ���벻ˮ�⣬����NaHA��Һ����������Na2A����Һ����A2��+H2OHA��+ OH-��H2OH++OH-����ƽ�⣬����c(Na��)>c(A2��)>c(OH��)>c(HA��)����A��ȷ��Na2A����ҺNa��Aԭ�Ӹ�������2:1��H2A��һ��������ȫ����Һ��û��H2A���ӣ����������غ㣬c(Na��)=2c(HA��)+2c((A2��)����B�����ݵ���غ㣬c(Na��)+c(H��)=c(HA��)+2c(A2��)+c(OH��)����C�����������غ㣬c(OH��)=c(HA��)+c(H��)����D��ȷ��
2��9�� ��3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣬ˮ�����ӷ���ʽ��CO32-��H2OHCO��OH����HCO��H2OH2CO3��OH����ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ�����ˮ�������c(OH��)��10��3mol��L��1����4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-����ˮ�⣬��ˮ��̶�CO32->HCO3-����������������������0.1 mol��L��1��Na2CO3��ѡ�ڣ���5����HA��H����A2�����棬����A2-ˮ�⣬Na2A��Һ�Լ�����H2A===H����HA�������棬HA��ֻ���벻ˮ�⣬����NaHA��Һ����������Na2A����Һ����A2��+H2OHA��+ OH-��H2OH++OH-����ƽ�⣬����c(Na��)>c(A2��)>c(OH��)>c(HA��)����A��ȷ��Na2A����ҺNa��Aԭ�Ӹ�������2:1��H2A��һ��������ȫ����Һ��û��H2A���ӣ����������غ㣬c(Na��)=2c(HA��)+2c((A2��)����B�����ݵ���غ㣬c(Na��)+c(H��)=c(HA��)+2c(A2��)+c(OH��)����C�����������غ㣬c(OH��)=c(HA��)+c(H��)����D��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Ũ�ȶ�Ϊ0.1mol��L��1HA��HB����Һ��20mL���ֱ���0.1mol��L��1NaOH��Һ�ζ�����Һ��pH�����NaOH��Һ���V�Ĺ�ϵ��ͼ��ʾ�������жϴ������
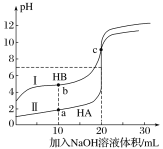
A. �ζ������У�ˮ�����c(H+)��c(OH��)������
B. ��ͬ�����£�HB�ĵ���̶�С��HA�ĵ���̶�
C. V=10mLʱ��c(HB)+c(B��)=2c(Na+)
D. V=20mLʱ��c(A��)>c(B��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��÷�¯��(��Ҫ��FeO��V2O5����������SiO2��P2O5������)��ȡV2O5���������£�

��1�����յ�Ŀ���ǽ�FeO��V2O3ת��Ϊ������NaVO3���ù����б�������Ԫ����_______________������������Ҫ�ɷ�Ϊ____________________(�ѧʽ)��
��2����MgSO4��Һ���衢��ʱ����������Ҫ�ɷ�Ϊ__________��
��3���ڱ���NH4VO3�Ĺ����У����������ļ���ֵ(������)���¶ȱ仯��������ͼ��ʾ��210��ʱ��ʣ��������ʵĻ�ѧʽΪ_____________________��

��4����V2O5ұ���������������ȷ����������ȷ�Ӧ��ʵ�������__________________.
��5����V2O5��������ϡ����õ�250mL(VO2)2SO4��Һ��ȡ25.00mL����Һ����ƿ�У���0.1000 mol��L-1H2C2O4����Һ���еζ����ﵽ�ζ��յ�ʱ���ı���Һ�����Ϊ20.00mL����֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)��
�ٸõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ��������___________________��
��(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ___________________��
�۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ�����ʹ���_________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������������̽����
��֪1 mol��ͬ�����ڲ�ͬ�����µ������
��ѧʽ | ���� | 1 mol�������/L |
H2 | 0 �棬101 kPa | 22.4 |
O2 | 0 �棬101 kPa | 22.4 |
CO | 0 �棬101 kPa | 22.4 |
H2 | 0 �棬202 kPa | 11.2 |
CO2 | 0 �棬202 kPa | 11.2 |
N2 | 273 �棬202 kPa | 22.4 |
NH3 | 273 �棬202 kPa | 22.4 |
��1�����ϱ������ó��Ľ��ۣ�
��1 mol�κ����壬�ڱ�״���µ������ԼΪ________��
��1 mol��ͬ�����壬�ڲ�ͬ�������£����________(�һ������һ��������һ����)��ȡ�
��2���������ݣ���ͬ�����£�1 mol�κ���������������ȣ�ԭ���ǣ�
��________________________________________________________________________��
��________________________________________________________________________��
��3��Ӧ�ã��ڱ�״���£�4 g O2�����Ϊ��������(д���������)___________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���弰�仯����㷺����ҽҩ��������ȼ���ȣ���±����Ĺ�ҵ�������£�
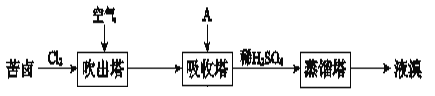
(1)Cl2�Ϳ�±�е�Br����Ӧ����Br2�����ӷ���ʽ��_____��
(2)���Ԫ�������ɽ���Cl�ķǽ�����ǿ��Br��ԭ��_____��
(3)�������У�A������Br2�����Һ�к���Br����BrO3������A��_____������ţ���
a��NaCl��Һ b��Na2CO3��Һ c��SO2����
(4)����������������Һ�м���ϡH2SO4�õ�Br2�����ӷ���ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������������̽����
��֪1 mol��ͬ�����ڲ�ͬ�����µ������
��ѧʽ | ���� | 1 mol�������/L |
H2 | 0 �棬101 kPa | 22.4 |
O2 | 0 �棬101 kPa | 22.4 |
CO | 0 �棬101 kPa | 22.4 |
H2 | 0 �棬202 kPa | 11.2 |
CO2 | 0 �棬202 kPa | 11.2 |
N2 | 273 �棬202 kPa | 22.4 |
NH3 | 273 �棬202 kPa | 22.4 |
��1�����ϱ������ó��Ľ��ۣ�
��1 mol�κ����壬�ڱ�״���µ������ԼΪ________��
��1 mol��ͬ�����壬�ڲ�ͬ�������£����________(�һ������һ��������һ����)��ȡ�
��2���������ݣ���ͬ�����£�1 mol�κ���������������ȣ�ԭ���ǣ�
��________________________________________________________________________��
��________________________________________________________________________��
��3��Ӧ�ã��ڱ�״���£�4 g O2�����Ϊ��������(д���������)___________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�뻷���������������ϡ����彡��ϢϢ��ء�
��1��2015�궬���ҹ����ִ�Χ����������������з���PM2.5�ض���Ⱦ������
��������Ϊ�������ӳ��д�����PM2.5Ũ�ȵ���______(�����)��
a��ȼ���̻�����
b��¶�������Ҷ
c��Ϊ�������ɵ���ˮ����
��ȼú���������ڼ���PM2.5��д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ______________________________��
��2��������������������ͷ�չ����Ҫ���ʻ�����
�����в����������ϵ���______(�����)��
a���ֻ������������� b���л������������� c��ʯӢ����
�����ʯ�׳���ʯ��������Ҫ�ɷ���________(�����)��
a��C b��SiO2 c��Al2O3
������������ˮ�����ͨ���������õ��Ĺ�ͬԭ����____(�����)��
a��ʯ��ʯ���� b������������ c�����������d��ʯӢ
��3��ҩ���г���ҩƷ�ܶ�����a.�����b.��ù����c.��˾ƥ����d.θ��ƽ(����������)��
�������__________(�����������������������)��
����ʹ��ǰһ��Ҫ����Ƥ����������(Ƥ��)����______(�����)��
�������ӷ���ʽ����θ��ƽ����Ϊ����ҩ��ԭ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ���ǣ� ��
A. һ��������SiO2����������ᷴӦ��������������������
B. �Ʋ�����ˮ���ԭ�϶��õ�ʯ��ʯ
C. ���ڳ����²������������������ᷴӦ
D. ɳ�ӡ�ʯӢ��ˮ������Ҫ�ɷֶ���SiO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѡ���⣩�������A��B��С�⡣��ѡ������һ��С�⣬������Ӧ�Ĵ�������������������������AС�����֡�
A��[���ʽṹ������]
�ܵĺϽ����������;�dz��㷺��
(1)Co3+��̬��������Ų�ʽΪ_____��
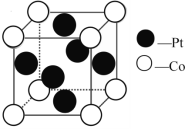
(2)һ��Pt��Co�����仯�������Ϊ���ӽ���Ĥȼ�ϵ�صĴ������侧���ṹ��ͼ��ʾ���ý����仯����Ļ�ѧʽΪ_____��
(3)BNCP�����ڼ��������ȣ�BNCP����HClO4��CTCN��NaNT����Ӧ�Ʊ���
��ClO4���Ŀռ乹��Ϊ_____(����������)��
��CTCN�Ļ�ѧʽΪ[Co(NH3)4CO3]NO3����Co(��)�γ���λ����ԭ����_____(��֪CO32���ĽṹʽΪ��![]() )��
)��
��NaNT����![]() (˫���谷)Ϊԭ���Ʊ���˫���谷��̼ԭ���ӻ��������Ϊ_____��1mol�÷����к�
(˫���谷)Ϊԭ���Ʊ���˫���谷��̼ԭ���ӻ��������Ϊ_____��1mol�÷����к�![]() ������ĿΪ_____��
������ĿΪ_____��
B��[ʵ�黯ѧ]
EDTA(�Ҷ���������)�����ϼ��Ĵ�����(�е�Ϊ116~117.2��)���������Ʊ�EDTAFeNa��3H2O�ȡ�ʵ�����Ʊ�EDTA��ʵ�鲽�����£�
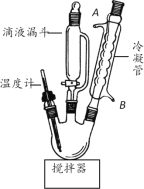
����1����������ƿ�м���22.5gClCH2COOH��45mLH2O�������ܽ⣻�ڲ��Ͻ����£�����22gNaOH��60mLH2O��6.6g H2NCH2CH2NH2������������ɵ���Һ���ӵ�Һ©���в��ϵμӵ�������ƿ�С�
����2��������Ϻ����µ�102��106�������£����ڲ����� pHԼΪ9������2h��
����3���������̿�����衢���á����ˡ�
����4����Һ�������ữ��pH=1�����á��ᾧ�����ˡ�ϴ�ӡ�����Ƶ�EDTA��
(1)ͼ��������װ�õ�������_____��ˮ�ӽӿ�_____(����)ͨ�롣
(2)����3�м������̿��Ŀ����_____���ⶨ��ҺpH�ķ�����_____��
(3)����4�С�ϴ�ӡ�ʱ����˵����ϴ����ȫ�ķ�����_____��
(4)�벹��������EDTA��NaHCO3��FeCl3��6H2OΪԭ���Ʊ�EDTAFeNa��3H2O��ʵ�鷽��(��֪EDTANa4+FeCl3![]() EDTAFeNa + 3NaCl)����250mL�ձ������μ���160mL����ˮ��23gEDTA����������ȫ�ܽ⣬_____���ٷִμ���21.6g FeCl3��6H2O������20min����pHС��5����ȴ�����ˡ�ϴ�ӡ������EDTAFeNa��3H2O(ʵ������ʹ�����Լ�Ϊ��NaHCO3������Ϊ26.8g)��
EDTAFeNa + 3NaCl)����250mL�ձ������μ���160mL����ˮ��23gEDTA����������ȫ�ܽ⣬_____���ٷִμ���21.6g FeCl3��6H2O������20min����pHС��5����ȴ�����ˡ�ϴ�ӡ������EDTAFeNa��3H2O(ʵ������ʹ�����Լ�Ϊ��NaHCO3������Ϊ26.8g)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com