
【题目】在密闭绝热容器中发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H<0下列有关说法不正确的是 ( )
SO3(g)+NO(g) △H<0下列有关说法不正确的是 ( )
A. 增大SO2的浓度,平衡正向移动
B. 使用催化剂,正反应速率和逆反应速率同时增大
C. 反应达到平衡时,扩大容器体积,平衡逆向移动
D. 反应达到平衡时,降低温度,平衡正向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)请把下列几组物质进行归类。
A.金刚石与足球烯
B.D与T

①互为同位素的是________(填字母,下同);
②互为同素异形体的是________;
③互为同分异构体的是________;
④属于同一种物质的是________。
(2)写出下列工业生产过程所涉及的主要反应的化学方程式。
①用铝热法炼铁:___________________________________。
②用电解法炼铝:______________________________________。
③生产聚乙烯塑料:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
H2(g)+CO2(g) △H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
A. 升高温度 B. 再加入2n mol H2
C. 再加入n mol CO和n mol H2O D. 再加入2n mol CO2和2n mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A到F是化合物,且A、B、E、F均含钠元素,G是单质.

(1)写出A、B、E、F的化学式:A________,B________,E________,F________.
(2)写出反应①②③的化学方程式:① _____________________________② _________________________________③__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个坐标图分别表示四个实验过程中某些量的变化,其中不正确的是( )

A. 向盐酸和氯化钙的混合溶液中加入碳酸钠 B. 向氢氧化钠溶液中加水
C. 双氧水分解 D. 向饱和氯化钠溶液中加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A. 18g重甲基(-CD3)中含有的电子数为9NA
B. 22.4L(标准状况)CH2Cl2中含C-H键数为2NA
C. 10g34%H2O2溶液与足量的酸性KMnO4溶液充分反应,转移的电子数为0.2NA
D. 0.1mol由乙烯与乙醇组成的混合物完全燃烧所消托的氧气分子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
【答案】C
【解析】①1mol N≡N键断裂的同时,有6mol N-H键断裂,说明正逆反应速率相等,反应达到了平衡状态,故①选;②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1,因未说明二者表示的是正反应速率还是逆反应速率,则不能说明正逆反应速率相等,反应不一定达到平衡状态,故②不选;③根据质量守恒可知,该反应在反应前后质量不变,又因容器恒容,所以反应体系的密度始终不变,则体系气体密度不再改变不能说明反应达到平衡状态,故③不选;④NH3、N2、H2的体积分数都不再改变,说明正逆反应速率相等,反应达到了平衡状态,故④选;⑤因该反应是在恒容隔热容器中进行,则体系温度不再改变,说明反应达到了平衡状态,故⑤选,综上所述,答案选C。
【题型】单选题
【结束】
18
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A. KSP(AB2)小于KSP(CD),说明AB2的溶解度小于CD的溶解度
B. AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
C. 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)>Ksp(AgBr)
D. 将0.001 mol·L-1 的AgNO3溶液与0.001 mol·L-1的KCl溶液等体积混合,无沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。
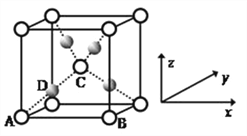
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com