
【题目】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)![]() 1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
反应b:2C(s)+N2O4(g)![]() N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
则NO2生成N2O4的热化学方程式为____。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 /td> |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:
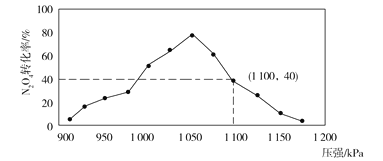
在1.1×106 Pa时该反应的化学平衡常数Kp=___(结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)![]() 5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____(填字母)。
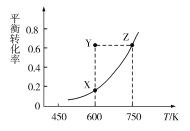
A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___。(精确到0.1%)
【答案】2NO2(g)![]() N2O4(g) ΔH=-36.0 kJ·mol-1(或NO2(g)
N2O4(g) ΔH=-36.0 kJ·mol-1(或NO2(g)![]() 1/2N2O4(g) ΔH=-18.0 kJ·mol-1) ac 0.032 mol·L-1·min-1 1.6×1011(Pa2) D 10.7%
1/2N2O4(g) ΔH=-18.0 kJ·mol-1) ac 0.032 mol·L-1·min-1 1.6×1011(Pa2) D 10.7%
【解析】
(1)依据盖斯定律,反应2a-b可得:2NO2(g)![]() N2O4(g) ΔH=-36.0kJ·mol-1。
N2O4(g) ΔH=-36.0kJ·mol-1。
(2)①缩小容器体积,由于反应前后气体分子数不变,故平衡不移动,只是NO和N2浓度等比例增大,符合比例,a正确;活性炭为固体,不会影响平衡,b错误;加NO,平衡正向移动,则N2浓度增大,平衡移动不能抵消条件改变,达到新平衡后,NO浓度也增大,且与原平衡等效,c正确;反应放热,升温,平衡逆向移动,N2浓度减小,d错误。
②v(CO2)=v(N2)=0.32mol/L÷10min=0.032 mol·L-1·min-1。
(3)1100 kPa时N2O4(g)转化率为40%,设N2O4(g) 起始量为1mol,有:
2C(s)+N2O4(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量/mol 1 0 0
改变量/mol 0.4 0.4 0.8
平衡量/mol 0.6 0.4 0.8
则平衡时,总物质的量为1.8 mol,则N2O4分压为(0.6/1.8)×1.1×106 Pa,N2分压为(0.4/1.8)×1.1×106 Pa,CO2分压为(0.8/1.8)×1.1×106 Pa,代入平衡常数的表达式,化简为1.6×1011(Pa2)。
(4)①温度升高,CO的转化率增大,说明平衡向正向移动,则正向吸热,Q>0,A项错误;从X点到Y点,CO的转化率增大,加入CO,相当于加压,平衡逆移,转化率减小,B项错误;从Y点到Z点CO的转化率不变,如果增大压强,平衡逆向移动,CO的转化率减小,C项错误;600 K时Y点转化率大于X点转化率,反应向逆向移动,所以v正<v逆,D项正确。
② I2O5(s)+5CO(g)![]() 5CO2(g)+ I2(g)
5CO2(g)+ I2(g)
起始量/mol 5 0 0
改变量/mol 5×0.6 3 0.6
平衡量/molspan> 2 3 0.6
I2(g)的体积分数为0.6/(2+3+0.6)=10.7%。


科目:高中化学 来源: 题型:
【题目】实验室按照下图所示的操作程序用于提纯某种物质,下列分析一定正确的是

A. 该操作流程可用于分离水与四氯化碳
B. 操作I-定是过滤,目的是将固液分离
C. 可以用于从四氯化碳中提取碘单质
D. 可以提纯含少量BaSO4的NaCI固体混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 19.98 | 20.00 |
2 | 0.10 | 20.02 | 20.00 |
3 | 0.10 | 20.00 | 20.00 |
(1)滴定时可用的指示剂是__________________。
A.品红溶液 B.酚酞试液 C.石蕊试液
(2)排去碱式滴定管中气泡的方法应采用操作_________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定操作时,眼睛应注视____________________________________________。
(4)滴定达到终点的现象____________________________________________________。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_______(填“偏高”或“偏低”或“不影响”,下同);碱式滴定管滴定前仰视滴定后俯视,对测定结果的影响是_______;锥形瓶用水洗净后没用酸润洗,结果会________。
(6)根据上述数据,计算出该盐酸的浓度约为__________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究有机物的方法有很多,常用的有①核磁共振氢谱②蒸馏③重结晶④萃取⑤红外光谱⑥过滤,其中用于分子结构确定的有____(填序号)。
(2)下列物质中,其核磁共振氢谱中只有一个吸收峰的是____(填字母)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(3)某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。如图是该有机物的质谱图,则其相对分子质量为______,分子式为________。
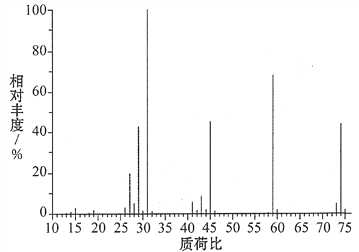
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+![]() =H2O+BaSO4↓
=H2O+BaSO4↓
C.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.铜片跟硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
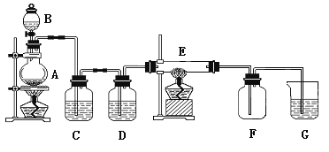
试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SiO2、NO2属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铝、过氧化钠都属于离子化合物
③漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物均属于混合物
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤硅导电,食盐水导电均属于物理变化
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物的种类非常丰富,请回答下列问题:
(1)已知:![]()
![]()
![]()
![]() 则
则![]()
![]() _____________。
_____________。
(2)![]() 温度时在容积为2L的恒容密闭容器中充入
温度时在容积为2L的恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,
,![]() ,
,![]() 时达到平衡,此时
时达到平衡,此时![]() 转化率为80%,
转化率为80%,
①![]() 内该反应的平均速率
内该反应的平均速率![]() _____________;
_____________;
②![]() 温度时该反应的化学平衡常数
温度时该反应的化学平衡常数![]() ___________;
___________;
③若不改变外界条件,向平衡后的容器中再通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量_____________。(填“变大”“变小”或“不变”)
在体系中的百分含量_____________。(填“变大”“变小”或“不变”)
(3)工业合成氨的反应原理为:![]() ,
,![]() 。对于该反应,既可以提高平衡体系中
。对于该反应,既可以提高平衡体系中![]() 的百分含量,又能加快反应速率的措施是(______)(填序号)
的百分含量,又能加快反应速率的措施是(______)(填序号)
a.升高温度 b.将平衡体系中的氨气分离出来 c.增大体系压强 d.加入合适的催化剂
(4)如图所示,![]() 温度时,
温度时,![]() 和
和![]() 的投料比与平衡时
的投料比与平衡时![]() 体积分数的关系。(不考虑
体积分数的关系。(不考虑![]() 与
与![]() 之间的相互转化)
之间的相互转化)

横坐标代表![]() 和
和![]() 的投料比,纵坐标代表平衡时
的投料比,纵坐标代表平衡时![]() 体积分数,计算最高点
体积分数,计算最高点![]() 时
时![]() 的平衡体积分数为_____________。
的平衡体积分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com