
【题目】阿伏加德罗常数的近似值为6.02×1023.按要求完成下列填空:
(1)1molCl2中约含有______个氯气分子,约含有______个氯原子,含有6.02×1023个氢原子的H2SO4的物质的量是______;
(2)标准状况下11.2LN2O4和______molNO所含有的原子数相等。
(3)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42-的物质的量是______。
(4)2L1mol/LMgCl2中镁离子的物质的量为______,Cl-的物质的量浓度为______。
【答案】6.02×1023 1.204×1024 0.5mol 1.5 0.25mol 2mol 2mol/L
【解析】
(1)根据n=![]() 计算分子数目,结合1个Cl2中含有2个Cl原子计算Cl原子数目;根据硫酸分子中含有的各种元素的原子个数关系计算硫酸的物质的量;
计算分子数目,结合1个Cl2中含有2个Cl原子计算Cl原子数目;根据硫酸分子中含有的各种元素的原子个数关系计算硫酸的物质的量;
(2)根据n=![]() 计算N2O4的物质的量,然后根据分子中含有的原子数目及NO中含有的原子数目关系计算NO的物质的量;
计算N2O4的物质的量,然后根据分子中含有的原子数目及NO中含有的原子数目关系计算NO的物质的量;
(3)根据硫酸钠电离产生的Na+与SO42-的关系,由Na+的数目计算SO42-的数目,再由n=![]() 计算 SO42-的物质的量;
计算 SO42-的物质的量;
(4)根据c=![]() 计算MgCl2的物质的量,然后根据电解质电离产生的离子关系计算。
计算MgCl2的物质的量,然后根据电解质电离产生的离子关系计算。
(1) 由n=![]() 可计算出1molCl2中含有的Cl2分子数目N(Cl2)=nNA=1mol×6.02×1023/mol=6.02×1023;由于1个Cl2分子中含有2个Cl原子,所以NA个Cl2分子中含有的Cl原子数目为N(Cl)=2N(Cl2)=2NA=2×6.02×1023=1.204×1024;
可计算出1molCl2中含有的Cl2分子数目N(Cl2)=nNA=1mol×6.02×1023/mol=6.02×1023;由于1个Cl2分子中含有2个Cl原子,所以NA个Cl2分子中含有的Cl原子数目为N(Cl)=2N(Cl2)=2NA=2×6.02×1023=1.204×1024;
H2SO4分子中含有2个H原子,则含有6.02×1023个氢原子的H2SO4分子数目为6.02×1023÷2=3.01×1023,则硫酸的物质的量是n(H2SO4)=![]() =0.5mol;
=0.5mol;
(2)由n=![]() 可计算出标准状况下11.2LN2O4的物质的量n=
可计算出标准状况下11.2LN2O4的物质的量n=![]() =0.5mol,由于在1个N2O4分子中含有6个原子,则0.5molN2O4中含有原子的物质的量为n(原子)=6n(N2O4)=6×0.5mol=3mol,在1个NO中含有2个原子,则含有3mol原子的NO气体的物质的量n(NO)=3mol÷2=1.5mol;
=0.5mol,由于在1个N2O4分子中含有6个原子,则0.5molN2O4中含有原子的物质的量为n(原子)=6n(N2O4)=6×0.5mol=3mol,在1个NO中含有2个原子,则含有3mol原子的NO气体的物质的量n(NO)=3mol÷2=1.5mol;
(3)硫酸钠电离方程式为Na2SO4=2Na++SO42-可知,N(SO42-)=![]() N(Na+)=
N(Na+)=![]() ×3.01×1023 =1.505×1023,则根据n=
×3.01×1023 =1.505×1023,则根据n=![]() 可知SO42-的物质的量;n(SO42-)=1.505×1023÷6.02×1023/mol=0.25mol;
可知SO42-的物质的量;n(SO42-)=1.505×1023÷6.02×1023/mol=0.25mol;
(4)c=![]() ,则n(MgCl2)=cV=1mol/L×2L=2mol,根据MgCl2电离方程式MgCl2=Mg2++2Cl-,可知n(Mg2+)= n(MgCl2)= 2mol,由于物质在同一溶液中,溶液的体积相同,c(Cl-)=c(MgCl2)=2×1mol/L=2mol/L。
,则n(MgCl2)=cV=1mol/L×2L=2mol,根据MgCl2电离方程式MgCl2=Mg2++2Cl-,可知n(Mg2+)= n(MgCl2)= 2mol,由于物质在同一溶液中,溶液的体积相同,c(Cl-)=c(MgCl2)=2×1mol/L=2mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
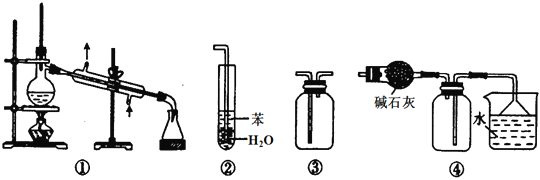
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使1L1.0mol·L-1 NaOH溶液的浓度增大一倍,可采取的合理措施是( )
A.加入40g固体NaOH,搅拌、溶解
B.将溶液取出500mL
C.加入1L3.0mol·L-1的NaOH溶液混合均匀
D.加入5mol·L-1NaOH溶液1L,再加水稀释至3L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A是一种能使红色石蕊试液变蓝的气体,甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成。请回答下列问题:
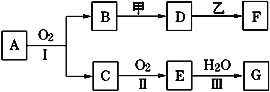
(1)写出甲的电子式是___________;
(2)写出反应Ⅰ的化学方程式__________;
(3)A溶于水得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为______________;用含a和b的代数式表示出该混合溶液中X的电离平衡常数_______________________。
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过如图装置处理污水。
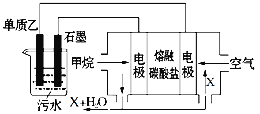
① 电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ.___; Ⅱ.______。
② 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参加循环,X物质的化学式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
A. 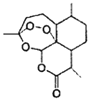 青蒿素的分子式是
青蒿素的分子式是![]()
B. 青蒿素所有碳原子均在同一平面上
C. 青蒿素在碱性条件下不能稳定存在
D. 青蒿素可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)3.01×1023个氯气分子的物质的量是________________ ;
(2)4g金属钙的物质的量是________________;
(3)1molH2O的质量为________________;
(4)24g O2分子所含氧原子数目(用NA表示)________________;
(5)在标准状况下,33.6L NH3的物质的量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制240mL 1.00mol·L-1 Na2CO3溶液,请回答有关问题。
(1)配制时,下列4个操作的顺序是(用序号表示,每个操作只能用一次)____。
①将已冷却的Na2CO3溶液沿玻璃棒注入____中;
②用天平准确称取____g Na2CO3固体,加入少量蒸馏水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解;
③塞上瓶塞,颠倒摇匀;
④继续往容量瓶内小心加水,直到液面接近刻度____处,改用____加水至溶液凹液面与刻度线相切。
(2)按上述步骤配制的Na2CO3溶液的浓度____(选填“是”或“不是”)1.00mol·L-1,理由是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com