
工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 ?? 。
(2)工业上可通过如下流程由粗硅制取纯硅:
| ||||||
|
| |||||
![]()
![]()
![]() Si(粗) SiCl4(l) Si(纯)
Si(粗) SiCl4(l) Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:
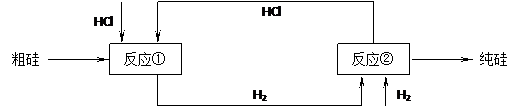
反应①: Si(粗)+3HCl(g) 553~573K SiHCl3(l)+H2(g)
反应②: SiHCl3+H2 1373K Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
(1)① SiO2+2C 3273K Si(粗)+2CO↑ ② Si+ C=SiC 若①×6+ ②得
6SiO2+13C 3273K 5Si(粗)+SiC+ 12CO↑ ,此时两者质量比为(12×13):(60×6)=13:30
(2)设需纯度为75%的石英砂x。
根据题意有下列关系式:
SiO2 ~ Si ~ SiCl4 ~ Si(纯)
60 28
x×75%×(1-10%)×80%×80% 100.8t (2分)
解得:x=500t (2分)
(3)设每轮生产投入的粗硅中含1molSi
则由反应①可知:
消耗HCl的物质的量为3 mol /75%=4mol,生成H2的物质的量为1mol(1分)
由反应②可知:
消耗H2的物质的量为1mol/80%=1.25mol,生成HCl的物质的量为3mol (1分)
则在一轮次的生产中,需补充投入HCl和H2的物质的量之比(即体积比)为:
(4mol-3mol)∶(1.25mol-1mol)=4∶1(1分)
(1)① SiO2+2C 3273K Si(粗)+2CO↑ ② Si+ C=SiC 若①×6+ ②得
6SiO2+13C 3273K 5Si(粗)+SiC+ 12CO↑ ,此时两者质量比为(12×13):(60×6)=13:30
(2)设需纯度为75%的石英砂x。
根据题意有下列关系式:
SiO2 ~ Si ~ SiCl4 ~ Si(纯)
60 28
x×75%×(1-10%)×80%×80% 100.8t (2分)
解得:x=500t (2分)
(3)设每轮生产投入的粗硅中含1molSi
则由反应①可知:
消耗HCl的物质的量为3 mol /75%=4mol,生成H2的物质的量为1mol(1分)
由反应②可知:
消耗H2的物质的量为1mol/80%=1.25mol,生成HCl的物质的量为3mol (1分)
则在一轮次的生产中,需补充投入HCl和H2的物质的量之比(即体积比)为:
(4mol-3mol)∶(1.25mol-1mol)=4∶1(1分)


科目:高中化学 来源: 题型:
| 3273K |
| 723~773K |
| 1373~1453K |

| 553~573K |
| 1373K |
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第19~26期 总第175~182期 人教课标版 题型:058
工业上用“三氯氢硅还原法”提纯粗硅,工艺流程如图所示:

(1)工业生产粗硅的主要原理是(用化学方程式表示):________.
(2)若在制粗硅的过程中同时生成了碳化硅,且二者的物质的量之比为1∶1,则参加反应的C和SiO2的质量之比为________.
(3)除上述反应外,还伴随着副反应:Si+4HCl![]() SiCl4+2H2.已知:SiHCl3、SiCl4在常温下均为液体,且SiCl4的沸点比SiHCl3的高.工业上分离SiHCl3、SiCl4的操作方法为________.
SiCl4+2H2.已知:SiHCl3、SiCl4在常温下均为液体,且SiCl4的沸点比SiHCl3的高.工业上分离SiHCl3、SiCl4的操作方法为________.
(4)该生产工艺中可以循环使用的物质是________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为____________。
(2)工业上可通过如下流程由粗硅制取纯硅:
Si(粗)![]() SiCl4(l)
SiCl4(l) ![]() Si(纯)
Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8 t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:

反应①:Si(粗)+3HCl(g) ![]() SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2![]() Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修1 3.2功能各异的无机非金属材料练习卷(解析版) 题型:填空题
单晶硅是现代信息基础材料。工业上,硅是在电炉中用炭粉还原二氧化硅制得的。
(1)若往电炉里加入二氧化硅和炭粉的混合物,通电,使它们发生如下反应生成硅:2C+SiO2 2CO↑+Si
2CO↑+Si
从保护生态环境和建设节约型社会等方面来说,在该生产环节中需要注意的主要问题是________________________________________________________________________
________________________________________________________________________。
(2)以上生产所得到的硅不纯,称为“粗硅”。一些高新技术产品的元件中使用的硅是极其纯净、几乎没有任何缺陷的单晶硅。
①工业上,硅的提纯原理为在加热下让粗硅与氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅。请写出上述过程中有关反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
②实验室中,将细沙粉(SiO2)与镁粉混合加热,也可制得粗硅。这种粗硅往往含有过量的镁、氧化镁和硅化镁(Mg2Si),这些杂质可用盐酸除去(提示:Mg2Si与盐酸反应的产物之一是SiH4)。请写出在实验过程中所发生的氧化还原反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com