
25 ℃、101 kPa下:
①2Na(s)+1/2O2(g)====Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)====Na2O2(s) ΔH2=-511 kJ·mol-1
下列说法正确的是:
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.0 ℃、101 kPa ,1molNa在O2中完全燃烧放出255.5KJ的热量
科目:高中化学 来源: 题型:
将含有杂质的4.0 g的NaOH固体配成1000 mL溶液,取20 mL溶液置于锥形瓶中,用0.1 mol·L-1盐酸滴定(甲基橙作指示剂),消耗盐酸20.4 mL,则该NaOH固体中含有的杂质可能是( )
A.Na2O B.Na2CO3
C.NaHCO3 D.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
根据题目提供的溶度积数据进行计算并回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为____________________。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________。
②完全沉淀后,溶液的pH=__________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?________________(填“是”或“否”)。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于10-5mol·L-1时,沉淀就达完全。下列叙述正确的是( )
A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp不变
C.向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO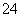 完全沉淀
完全沉淀
D.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
| 离子 | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如图所示:
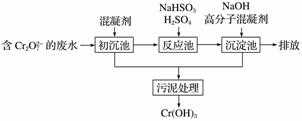
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为________________________(用离子方程式表示)。
②反应池中发生主要反应的离子方程式是Cr2O +3HSO
+3HSO +5H+===2Cr3++3SO
+5H+===2Cr3++3SO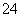 +4H2O。根据“沉
+4H2O。根据“沉
淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是________________________________________________________________________、
________________________________________________________________________。
证明Cr3+沉淀完全的方法是_________________________________________________。
(2)工业可用电解法来处理含Cr2O 废水。实验室利用如图装置模拟处理含Cr2O
废水。实验室利用如图装置模拟处理含Cr2O 的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+
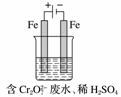
与酸性溶液中的Cr2O 反应的离子方程式是
反应的离子方程式是
________________________________________________________________________,
得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01 mol Cr2O 时,得到沉淀的质量至少是________g。
时,得到沉淀的质量至少是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表中的一部分,表中所列字母分别表示一种元素。(选项中的物质都由下表中的元素组成)
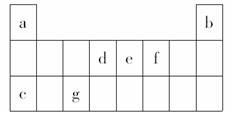
由以上信息可推断下列说法正确的是:
A.宇航员在飞船活动舱内会产生d和f组成的气体,吸收这种气体的化合物应该由e和f组成
B.活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质
C.c和f以原子个数之比为1:1组成的化合物可用作宇航员所需f单质的来源
D.《阿凡达》中潘多拉星球上存在32b,地球上此元素主要以42b形式存在,32b比42b少一个质子
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是:

A.R的氧化物在空气中与其它物质作用可形成光化学烟雾
B.常温下丁的浓溶液可用T单质所制的容器来盛装
C.丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D.甲、乙、丙、丁受热均易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,B2+与C-具有相同的电子层结构,下列叙述不正确的是 ( )
A.离子半径A2->C->B2+ B.它们的原子序数A>B>C
C.它们的原子半径C>B>A D.原子最外层上的电子数B>A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com