
【题目】用下列装置能达到实验目的的是( )
A. 实验室制取氨气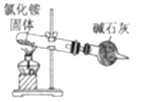
B. 测定化学反应速率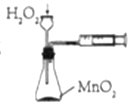
C. 验证非金属性:N﹥C﹥Si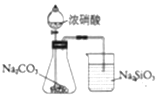
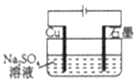
D. 实现反应:Cu+2H2O![]() Cu(OH)2+H2
Cu(OH)2+H2![]()
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_______。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是____________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。
注意事项:
1、本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2、密封保存,请勿与洁厕灵同时使用。
3、保质期为一年。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知氯气通入热的苛性钠溶液中会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中还原剂是___(填化学式);把此反应改写成离子方程式:___;
(2)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:3Cl2+6NaOH=5NaCl +NaClO3+3H2O。___
(3)若生成1mol的NaClO3,转移的电子数是___;若反应中转移了2.5mol的电子,则消耗标况下Cl2的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 25℃时,加水稀释0.1mol/LNH4Cl,溶液中![]() 增大
增大
B. 反应2NO+O2=2NO2常温下可自发进行,该反应为吸热反应
C. 用NaOH标准溶液滴定未知浓度的CH3COOH溶液时,使用酚酞作指示剂
D. 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置可以测定混合气体中ClO2的含量:
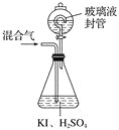
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
(1)锥形瓶内ClO2与碘化钾反应的离子方程式为____________________________。
(2)玻璃液封装置的作用是_______________________。
(3)V中加入的指示剂通常为_____,滴定至终点的现象是_______。
(4)测得混合气中ClO2的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲中含有的化学键类型是___;常温下丁溶液显___性(填“酸”或“碱”或“中”),原因是____(用离子方程式表示);
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1∶2(M均显+1价),原子序数B大于A。回答下列问题:
①写出加热条件下上述生成丙的化学方程式____;
②已知常温下弱电解质的电离平衡常数如下:一水合氨![]() ,戊:
,戊:![]() ,
,![]() 。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为
。若一水合氨与丁恰好完全反应生成酸式盐,则浓度为![]() 的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中
的该盐溶液pH___7(填“>”“<”或“=”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____
____![]() (同上)。
(同上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。
已知:①氯气与碱反应放出热量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
试回答下列问题:

(1)甲装置中仪器a的名称是________________________。
(2)装置乙中饱和食盐水的作用是________________________。
(3)装置丁中发生反应的化学方程式为_____________________。
(4)漂白粉在空气中失效的原因是______________、______________(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是________ 。
②为提高Ca(ClO)2的含量。可采取的措施是___________(任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数;______________
(2)混合后溶液的物质的量浓度;(保留到小数点后一位,下同)___________
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com