
| A、常温下浓硫酸遇到铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 |
| B、盐析可提纯蛋白质并保持其生理活性 |
| C、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| D、锌的金属活泼性比铁的强,可在海轮外壳上装若干锌块以减缓其腐蚀 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
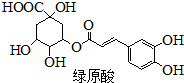 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A、奎尼酸分子式为C7H14O6 |
| B、绿原酸能发生取代、加成、消去和缩聚反应 |
| C、1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH |
| D、咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行蒸发操作时,应将混合物中的水分完全蒸干后,才能停止加热 |
| B、进行蒸馏操作时,蒸馏烧瓶中应加入几粒沸石 |
| C、进行分液操作时,分液漏斗中下层液体先从下口放出,上层液体后从下口放出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
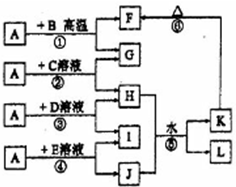 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积Kw随温度、外加酸(碱)浓度的改变而改变 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、当弱电解质电离成离子的速率与离子结合成分子的速率相等时达到电离平衡状态 |
| D、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中的离子浓度有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com