
某温度时,AgCl(s)⇌Ag+(aq)+Cl﹣(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是()

A. 加入AgNO3,可以使溶液由c点变到d点
B. 加入少量水,平衡右移,Cl﹣浓度减小
C. d点没有AgCl沉淀生成
D. c点对应的Ksp等于a点对应的Ksp
考点: 难溶电解质的溶解平衡及沉淀转化的本质.
分析: A.加入AgNO3,c(Ag+)增大,c(Cl﹣)减小;
B.溶液存在溶解平衡,加入少量水,促进溶解,如认为饱和溶液,则离子浓度不变;
C.d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数;
D.温度一定溶度积常数不变.
解答: 解:A.加入AgNO3固体,银离子浓度增大,氯离子浓度减小,而cd点氯离子浓度相同,故A错误;
B.溶液存在溶解平衡,加入少量水,促进溶解,如认为饱和溶液,则离子浓度不变,故B错误;
C.d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数,有氯化银沉淀生成,故C正确;
D.温度不变Ksp不变,ac点是相同温度下的溶解沉淀平衡,Ksp相同,故D正确;
故选CD.
点评: 本题考查沉淀溶解平衡,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
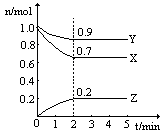 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 元素的单质可由氧化或还原含该元素的化合物来制得
B. 得电子越多的氧化剂,其氧化性越强
C. 阳离子只能得到电子被还原,只能作氧化剂
D. 含有最高价元素的化合物一定具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤、洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
请根据上面叙述,回答:
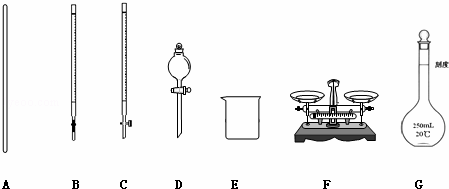
(1)如图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母).
(2)写出步骤③中发生反应的离子方程式 ﹣;.
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 .
(4)如何确定沉淀是否洗涤干净的操作是 .
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为×100%.(列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的.你认为甲学生的观点是否正确?正确(填正确或错误);请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施或事实不能用勒夏特列原理解释的是()
A. 新制的氯水在光照下颜色变浅
B. Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. H2、I2、HI平衡混合气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述正确的是()
A. 0.1mol•L﹣1Na2CO3溶液中:[OH﹣]=[HCO3﹣]+[H+]+[H2CO3]
B. 0.1mol•L﹣1CH3COONa溶液中:[Na+]=[CH3COO﹣]+[OH﹣]
C. CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c (Na2CO3)<c(CH3COONa)
D. 向0.1mol•L﹣1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO﹣]>[Na+]>[OH﹣]=[H+]
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上12月月考化学试卷(解析版) 题型:填空题
按要求写出下列反应的化学方程式或离子方程式:
(1)硝酸见光分解的化学方程式__________________________;
(2)氨的催化氧化反应的化学方程式__________________________;
(3)锌与稀硝酸按物质的量比2:5反应的离子方程式__________________________;
(4)NaHCO3溶液与少量Ca(OH)2溶液反应的离子方程式__________________________;
(5)Cu2S与稀硝酸反应产生硝酸铜、硫酸、一氧化氮和水的化学方程式__________________________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷(解析版) 题型:选择题
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为

A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com