
| A. | x:y=3:1 | B. | v(A):v(C)=2:1 | ||
| C. | A的平衡浓度为0.4mol/L | D. | A与B的平衡浓度之比为3:2 |
分析 A、根据△c=v•△t计算△c(C),结合D的平衡浓度,利用浓度变化量之比等于化学计量数之比确定x:y的值;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,得x;
C、根据D的平衡浓度计算△c(A),c(A)起始-△c(A)=c(A)平衡;
D、根据D的平衡浓度计算△c(A)、△c(B),起始浓度-浓度变化量=平衡浓度,据此计算判断.
解答 解:A、△c(C)=0.3mol/(L•min)×2min=0.6mol/L,D的平衡浓度为0.3mol/L,浓度变化量之比等于化学计量数之比,故x:y=0.6mol/L:0.3mol/L=2:1,故A错误;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,故x=2,所以v(A):v(C)=2:2=1:1,故B错误;
C、由A、B分析可知y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为$\frac{5mol}{5L}$-0.6mol/L=0.4mol/L.故C正确;
D、y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为$\frac{5mol}{5L}$-0.6mol/L=0.4mol/L,△c(B)=3×0.3mol/L=0.9mol/L,B的平衡浓度为$\frac{8mol}{5L}$-0.9mol/L=0.7mol/L,故A与B的平衡浓度之比为0.4mol/L:0.7mol/L=4:7,故D错误;
故选C.
点评 本题考查化学平衡及反应速率的有关计算,难度不大,推断x、y的值是关键,注意基础知识理解掌握.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
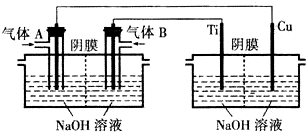
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
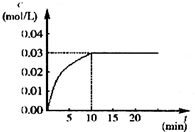 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 加热莫尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中白色粉末先变成天蓝色,后又变成深蓝色 | 温度较低时莫尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向KMnO4溶液中通入SO2气体 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中一定含有SO42- |
| D | 取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸.水浴加热5min后取少量溶液,加入少量新制Cu(OH)2,加热4min | 未产生砖红色沉淀 | 蔗糖不能水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3溶液在空气中加热蒸干并灼烧后,可以得到Fe2(SO4)3 | |
| B. | 为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入氨水,过滤后向滤液中再加入适量盐酸 | |
| C. | 配制FeSO4溶液时,为了抑制亚铁离子水解,需加入少量Fe | |
| D. | 室温下,向PH=4的醋酸溶液中加入等体积的PH=10的NaOH溶液,反应后溶液呈碱性,是因为生成了强碱弱酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是σ键,没有π键 | B. | 都是π键,没有σ键 | C. | 既有π键,又有σ键 | D. | 除CH4外,都是σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾元素化合价降低 | B. | Fe(OH)3发生氧化反应 | ||
| C. | 该反应是置换反应 | D. | Cl2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com