
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
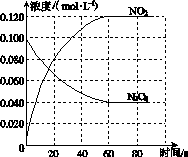
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
(1)大于 0.001 0 0.36 mol·L-1
(2)①大于 反应正方向吸热,反应向吸热方向进行,故温度升高
②平衡时,c(NO2)=0.120 mol·L-1+0.002 0 mol·L-1·s-1×10 s×2=0.16 mol·L-1
c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1
K2=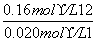 =1.3 mol·L-1
=1.3 mol·L-1
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
[解析] (1)依题意知,温度升高,混合气体的颜色加深,说明平衡向生成NO2的正反应方向移动,即正反应是吸热反应;根据图像0~60 s时段,NO2的物质的量浓度变化为0.060 mol·L-1,根据公式v= 即可计算出速率;根据图像可知NO2的平衡浓度为0.120 mol·L-1,N2O4的平衡浓度为0.040 mol·L-1,根据K=
即可计算出速率;根据图像可知NO2的平衡浓度为0.120 mol·L-1,N2O4的平衡浓度为0.040 mol·L-1,根据K=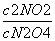 可计算出平衡常数K1。(2)①根据题意知,改变反应温度为T后,反应速率降低,故为降低温度,即T小于100 ℃;②根据题意知,再次达到平衡后N2O4的浓度减小,Δc=v·Δt=0.002 0 mol·L·s-1×10 s=0.02 mol·L-1,则NO2的浓度增加0.040 mol·L-1,即达到新平衡时N2O4的浓度为0.020 mol·L-1,NO2的浓度为0.160 mol·L-1,据K=
可计算出平衡常数K1。(2)①根据题意知,改变反应温度为T后,反应速率降低,故为降低温度,即T小于100 ℃;②根据题意知,再次达到平衡后N2O4的浓度减小,Δc=v·Δt=0.002 0 mol·L·s-1×10 s=0.02 mol·L-1,则NO2的浓度增加0.040 mol·L-1,即达到新平衡时N2O4的浓度为0.020 mol·L-1,NO2的浓度为0.160 mol·L-1,据K=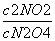 可计算出平衡常数K2。(3)温度为T时,反应达到平衡,将反应容器减小一半,即增大压强。其他条件不变时,增大压强,平衡向气体分子数减小的方向移动,即向逆反应方向移动。
可计算出平衡常数K2。(3)温度为T时,反应达到平衡,将反应容器减小一半,即增大压强。其他条件不变时,增大压强,平衡向气体分子数减小的方向移动,即向逆反应方向移动。


科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO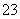 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO +4NH
+4NH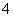 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO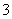 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
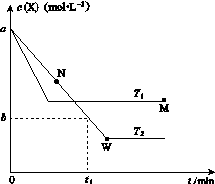
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=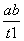 mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)  N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
| A | B |
|
|
|
| 升高温度,平衡常数减小 | 0~3 s内,反应速率为 v(NO2)=0.2 mol·L-1 |
| C | D |
|
|
|
| t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变
C.氧气压强不变 D.BaO2量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S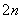
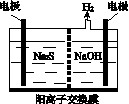
①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
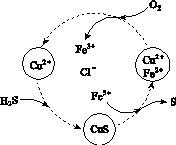
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。
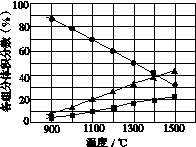
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________________。
(2)反应AX3(g)+X2(g)  AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
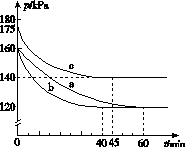
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b________________________________________________,c____________________________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ/mol
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ/mol
则CH4将NO2还原为N2的热化学方程式为__________________________________________________________。
(2)利用NH3催化还原氮氧化物又称SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的化学方程式为2NH3(g)+NO(g)+NO2(g)
 2N2(g)+3H2O(g) ΔH<0。
2N2(g)+3H2O(g) ΔH<0。
为提高氮氧化物的转化率可采取的措施是____________________________________________________(写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO NO2
NO2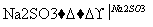 N2
N2
已知反应Ⅰ的化学方程式为2NO+ClO2+H2O===NO2+HNO3+HCl,则反应Ⅱ的化学方程式是____________________________________;若生成11.2 L N2(标准状况),则消耗ClO2________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S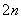
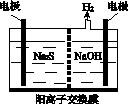
①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
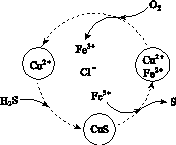
①在图示的转化中,化合价不变的元素是________。
②反应中当有1 mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__________________________________。
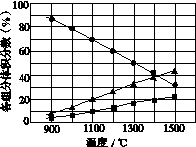
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com