

分析 软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可知软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体,据此分析解答.
解答 解:(1)软锰矿形成矿浆,通入足量的SO2,MnO2、Fe2O3与SO2反应生成Mn2+、Fe2+,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+;
故答案为:Mn2+、Fe2+;
(2)MnO2与SO2反应的化学方程式为MnO2+SO2=MnSO4;
故答案为:MnO2+SO2=MnSO4;
(3)由图可知,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃,
故答案为:90℃;
(4)NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率;
故答案为:防止NH4HCO3受热分解,提高原料利用率;
(5)Mn2+的滤液中加入NH4HCO3溶液后,发生彻底的双水解,生成MnCO3沉淀和二氧化碳,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(6)生成的MnCO3沉淀需经充分洗涤,若未洗涤干净,洗涤液中含有硫酸根离子,故检验洗涤液中是否含有硫酸根即可,方法为:取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净;
故答案为:取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、离子的检验等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ③⑤⑥ | C. | ①③⑤⑥⑦ | D. | ③⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 5mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质的溶度积Ksp越小,则它的溶解度越小 | |
| B. | 任何难溶物在水中都可以存在沉淀溶解平衡,给定温度的溶解度大小都可以用Ksp计算出来 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: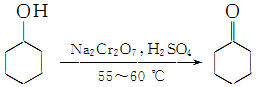 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1 | 0.962 | 能溶于水 |
| 环己酮 | 155.6 | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | - |
| 水 | 100.0 | 0.998 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 盐酸:强电解质 | Cl2:非电解质 | CaCO3:弱电解质 |
| B | CuSO4•5H2O:纯净物 | Al(OH)3:一元酸 | HD:单质 |
| C | Al2O3:离子化合物 | NaHCO3:正盐 | Na2O2:碱性氧化物 |
| D | 血液:胶体 | NO2:酸性氧化物 | H2O和D2O:混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O (l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O (g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-736 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com