
欲配制100mL 1.0mol•L﹣1Na2SO4溶液,正确的方法是()
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L﹣1Na2SO4溶液用水稀释至100mL.
A. ①② B. ②③ C. ①③ D. ①②③
考点: 配制一定物质的量浓度的溶液.
专题: 物质的量浓度和溶解度专题.
分析: ①14.2gNa2SO4的物质的量为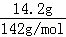 =0.1mol,根据c=
=0.1mol,根据c= 以及溶液的体积不等于溶剂的体积来分析;
以及溶液的体积不等于溶剂的体积来分析;
②32.2gNa2SO4•10H2O物质的量为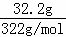 =0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,根据c=
=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,根据c= 计算判断;
计算判断;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,据此计算稀释后浓度,进行判断;
解答: 解:①14.2gNa2SO4的物质的量为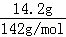 =0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
=0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
②32.2gNa2SO4•10H2O物质的量为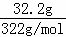 =0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c=
=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c= =1.0mol•L﹣1,故②正确;
=1.0mol•L﹣1,故②正确;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故③正确.
故选:B;
点评: 本题主要考查配制一定物质的量浓度的溶液的配制及对物质的量浓度的理解、计算,难度不大,注意配制中物质溶于水溶质发生变化的情况以及稀释前后溶质的物质的量不变.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)

回答下列问题:
(1)装置A中液体试剂选用 ,理由是 .
(2)装置B的作用是 .装置C的作用是 .装置E中碱石灰的作用是 .
(3)装置D中发生反应的化学方程式是 .
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度 .
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式H++OH﹣=H2O可表示的化学反应是( )
|
| A. | 盐酸和氢氧化钡的反应 | B. | 硝酸和氢氧化镁的反应 |
|
| C. | 硫酸和氢氧化钡的反应 | D. | 盐酸和氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④压强⑤刻度线 ⑥酸式或碱式这六项中的()
A. ②④⑥ B. ③⑤⑥ C. ①②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 mol.
(2)该气体所含原子总数为 个.
(3)该气体在标准状况下的体积为 L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为 %.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿佛加德罗常数的值,下列说法正确的是()
A. 常温常压下,8 g O2含有电子数目为4NA
B. 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA
C. 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA
D. 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为()
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com