
| 实验A | 条件 | 现象 |
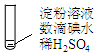 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
分析 (1)淀粉遇碘变蓝色,人们根据淀粉的这一特性来鉴定淀粉的存在;
(2)在酸性条件下,加热促进淀粉水解,淀粉水解生成葡萄糖,溶液中不存在淀粉,加入碘水后,溶液中不会变成蓝色;
(3)加入稀硫酸瞬间变蓝,这说明有碘单质生成,或碘单质的浓度增大,可能为碘离子、碘酸根离子在酸性条件下反应生成碘,也可能是在酸性条件下碘离子被氧气氧化,也可能为碘溶于水发生类似氯气和水的反应;
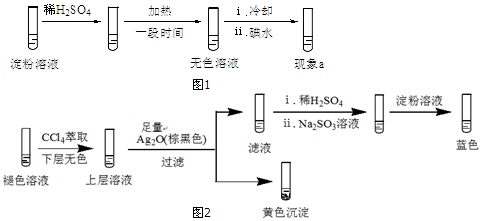
(4)①碘离子和氧化银反应生成碘化银黄色沉淀;
②氧化银的作用是同时除去碘离子和氢离子;
③滤液中加入硫酸和亚硫酸钠,然后加入淀粉,溶液变蓝色,说明有碘生成,推测滤液中含有的物质(或离子)可能是含碘元素的离子,具有氧化性,含碘元素的离子在酸性条件下易被还原;
(5)淀粉水解速率较慢,现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.
解答 解:(1)淀粉遇碘变蓝色是淀粉的特性,人们根据淀粉的这一特性来鉴定淀粉的存在,淀粉是由D-葡萄糖单体组成的同聚物,包括直链淀粉和支链淀粉两种类型,为植物中糖类的主要贮存形式;淀粉遇碘变蓝色,这并非是淀粉与碘发生了化学反应,而是淀粉螺旋中央空穴恰能容下碘分子,通过范德华力,两者形成一种络合物,这种络合物能比较均匀地吸收除蓝光以外的其它可见光,从而使淀粉变为深蓝色,
故答案为:I2;
(2)在酸性条件下,加热促进淀粉水解,淀粉水解生成葡萄糖,“现象a”是加入碘水后,溶液中无明显现象,不会变成蓝色,说明溶液中不存在淀粉,“现象a”证实冷却后平衡逆向移动该分析不合理,
故答案为:溶液不变蓝;
(3)加入稀硫酸瞬间变蓝,这说明有碘单质生成,或碘单质的浓度增大,可能为碘离子、碘酸根离子在酸性条件下反应生成碘,解释1:6H++5I-+IO3-═3I2+3H2O,也可能是在酸性条件下碘离子被氧气氧化,解释2:4H++4I-+O2═2I2+2H2O,也可能是由于碘溶于水发生类似氯气和水的反应,即溶液中存在平衡:2H++2I-+IO-?I2+H2O,加入硫酸,氢离子浓度增大,平衡向正反应方向移动,生成的碘单质与淀粉作用变成蓝色,
故答案为:解释1:6H++5I-+IO3-═3I2+3H2O,解释2:4H++4I-+O2═2I2+2H2O,解释3:2H++2I-+IO-?I2+H2O粉遇碘变蓝色是淀粉的特性;
(4)①测得溶液的pH≈5,溶液显酸性,碘离子和氧化银反应,产生的黄色沉淀为碘化银,反应为:2H++2I-+Ag2O═2AgI↓+H2O,
故答案为:2H++2 I-+Ag2O═2AgI+H2O;
②根据2H++2I-+Ag2O═2AgI+H2O可知,氧化银的作用是同时除去碘离子和氢离子,证明上层溶液中存在I-;沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能,
故答案为:证明上层溶液中存在I-;沉淀I-,排除向滤液中加入稀H2SO4后,因I-被氧化生成I2的可能;
③滤液中加入硫酸和亚硫酸钠,然后加入淀粉,溶液变蓝色,说明有碘生成,而亚硫酸钠具有还原性,则推测滤液中含有的物质具有氧化性,其还原产物是碘,可能是次碘酸或碘酸,所以推测滤液中含有的物质(或离子)可能是HIO(或IO-)、HIO3(或IO3-)、H+,
故答案为:HIO(或IO-)、HIO3(或IO3-)、H+;
(5)由于淀粉水解速率较慢,而碘在水中受热挥发反应较快,因而实验A中的ⅰ加热后碘挥发,部分I2与H2O发生反应,蓝色褪色,而实验ⅲ中经过较长时间,淀粉水解完全,因此蓝色最终褪色,
故答案为:现象ⅰ:部分I2挥发,部分I2与H2O发生反应;现象ⅲ:淀粉完全水解.加热时,I2与H2O的反应速率大于淀粉水解的速率.
点评 本题考查了探究碘水的性质,注意淀粉遇碘变蓝色是淀粉的特性,掌握碘单质以及化合物的化学性质,明确性质实验方案设计的原理,明确题中资料信息是解题根据,试题培养了学生的分析、理解能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
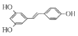 )具有预防心血管疾病的作用,其一种合成路线如图:
)具有预防心血管疾病的作用,其一种合成路线如图: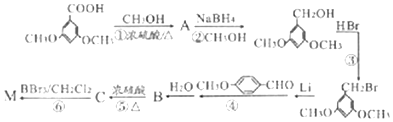
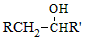
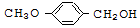 $\stackrel{BBr_{3}/CH_{2}Cl_{2}}{→}$
$\stackrel{BBr_{3}/CH_{2}Cl_{2}}{→}$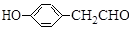 回答下列问题:
回答下列问题: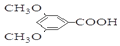 核磁共振氢谱中不同化学环境的氢原子个数比为6:1:2:1.
核磁共振氢谱中不同化学环境的氢原子个数比为6:1:2:1. .
. .
.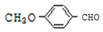 有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有3种.
有多种同分异构体,其中能发生银镜反应且苯环上一氯取代物只有两种的同分异构体有3种.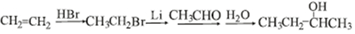 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
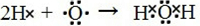
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
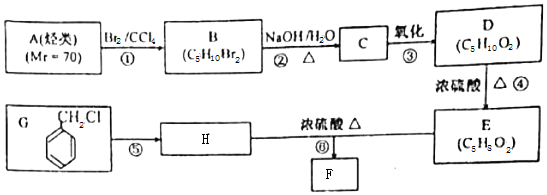
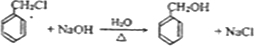 .
. .
.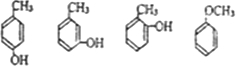 写出其中一种.
写出其中一种. .(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
.(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)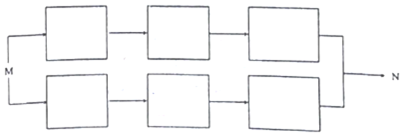
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>Y | |
| B. | Z的单质保存在X2Y中 | |
| C. | ZYX溶液和ZXW溶液都呈碱性,且原理相同 | |
| D. | 室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液的pH为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、Cl-、I- | B. | Cu2+、Na+、Cl-、NO3- | ||
| C. | K+、HCO3-、OH-、Ba2+ | D. | K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
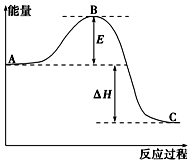 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com