
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-817.63 kJ•mol-1 |
分析 根据已知热化学方程式和目标反应的热化学反应方程式,利用盖斯定律将所给的反应①+②×2+③得到目标反应,将反应热做相应的变化即可得到.
解答 解:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H1=-533.23kJ•mol-1 ①
H2O(g)=H2O (l)△H2=-44kJ•mol-1 ②
2H2O2(l)=2H2O(l)+O2(g)△H3=-196.4kJ•mol-1 ③
则联氨与过氧化氢反应的热化学方程式可用①+②×2+③:N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.63kJ•mol-1
或用①-②×2+③:N2H4(g)+2H2O2(l)=N2(g)+4H2O(l)△H=-641.63kJ•mol-1,
故选C.
点评 本题以社会为背景,考查了热化学方程式的书写与盖斯定律的应用,难度不大,注意根据目标反应对所给的反应来变形.


科目:高中化学 来源: 题型:选择题
| A. | C8H10 | B. | C10H16 | C. | C12H22 | D. | C14H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯制溴苯、乙烯制乙醇 | |
| B. | 甲烷制一氯甲烷、苯制硝基苯 | |
| C. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的氢化物的电子式
E的氢化物的电子式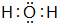 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 | B. | 氮气和氧气发生反应 | ||
| C. | 二氧化氮气体溶于水 | D. | 氨的催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
. 合成D 的路线流程图(其他原料任选)合成
合成D 的路线流程图(其他原料任选)合成查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com