
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入6 mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中Al3+的浓度(mol/L)为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
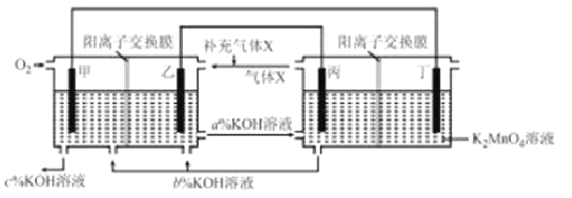
A. 电极丁的反应式为MnO42--e-= MnO4-
B. 电极乙附近溶液的pH减小
C. KOH溶液的质量分数:c%>a%>b%
D. 导线中流过2 mol电子时,理论上有2mol K+ 移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有________________________________。
(2)加入BaCl2的目的是_______________,加MgO后过滤所得滤渣的主要成分为___。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________________________,
再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;②___________;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol )。
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。反应的方程式为:
______Cr2O72-+___Fe2++___ H+= ___Cr3++___Fe3++____H2O (请配平)。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
写出步骤2中发生反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】愈创木酚是香料、医药、农药等工业的重要的精细化工中间体,工业上以邻硝基氯苯为原料合成愈创木酚的一种流程如下图所示。

(1)反应①②的类型依次是_________、__________。
(2)B物质中的官能团名称是_________。
(3)C物质的分子式是__________。
(4)已知C物质水解产物之一是氮气,写出反应④的化学方程式________________。(不要求写条件)
(5)愈创木酚的同分异构体中属于芳香化合物且含有三个取代基有_______种,其中含有氢原子种类最少的物质的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向质量分数为2a%,体积为10 mL,物质的量浓度为c1mol·L-1的稀H2SO4中加入V mL 的水,使之质量分数变为 a%,此时物质的量浓度为c2mol·L-1,则下列关系正确的是
A. V>10, 2c2=c1 B. V<10,2c2﹤c1
C. V>10,2c2<c1 D. V>10, 2c2>c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾是对大气中各种悬浮颗粒物含量超标的笼统表述,但雾和霾的区别很大。雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,属于自然现象。霾是空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍,属于大气污染。如图为霾的主要成分示意图。下列说法不正确的是
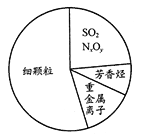
A. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
B. 雾天开车时,汽车车灯的光束在雾中能产生丁达尔效应
C. 苯、甲苯、二甲苯都属于芳香烃
D. SO2和NxOy都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应知识贯穿于中学化学教材,从初中阶段的简单了解,到高中基本理论知识,再到元素化合物部分的实际应用,再到化学电源本质的理解,再到有机化学中物质类型的变化关系,层层推进,高潮迭起。分析氧化还原反应常用双线桥法和单线桥法来表示电子转移的方向和数目。
I.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中:
(1)请用单线桥法标出电子转移的方向和数目________;
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________;
(3)若生成 0.3 mol Cl2,则转移的电子的数目为________________;
II.已知硫化亚铁是一种黑色块状固体,在空气中煅烧时生成二氧化硫气体和烧渣;硫化亚铁常温下难溶于水,易溶于稀盐酸、稀硫酸而生成能溶于水的硫化氢气体。硫化亚铁与浓硫酸加热条件下,可发生反应:2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑ +2S+6H2O:
Fe2(SO4)3+3SO2↑ +2S+6H2O:
(4)请用双线桥法标出电子转移的方向和数目_______。
(5)H2SO4在该反应中显示出来的性质是___________;(填序号)
A.氧化性 B.还原性 C.酸性 D.碱性
(6)该反应中,氧化产物是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com