
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_____________________。

(2)为防止氯气尾气污染空气,实验室通常用______溶液吸收多余的氯气,原理是__________________。
(用化学方程式表示)。
根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(填字母,下同)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,最适宜采用的该物质是_____________。
A.NaOH B.NaCl C.KCl D.Na2CO3
【答案】 干燥有色布条无明显变化,湿润有色布条颜色褪去 浓NaOH Cl2+2NaOH=NaCl+NaClO+H2O Ca(ClO)2 C D
【解析】试题分析:本题考查氯气的性质,氯气的漂白原理,氯气的尾气吸收,漂白粉的成分和变质。
(1)氯气没有漂白性;氯气的漂白原理是:氯气与水反应生成盐酸和次氯酸,次氯酸具有强氧化性,将有色物质漂白,所以氯气通过干燥有色布条无明显变化,通过湿润有色布条颜色褪去。
(2)为防止氯气尾气污染空气,实验室通常用浓NaOH溶液吸收多余的氯气,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。石灰乳吸收氯气制漂白粉的反应原理为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分为Ca(ClO)2。长期露置于空气中的漂白粉会发生反应:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑,漂白粉变质失效,加入盐酸后发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,则加入盐酸后产生的气体是CO2,答案选C。
2HCl+O2↑,漂白粉变质失效,加入盐酸后发生反应CaCO3+2HCl=CaCl2+H2O+CO2↑,则加入盐酸后产生的气体是CO2,答案选C。
(3)A项,NaOH虽然能吸收Cl2,但NaOH具有强腐蚀性,不宜采用;B项,NaCl不能吸收Cl2,不宜采用;C项,KCl 不能吸收Cl2,不宜采用;D项,Na2CO3能吸收Cl2,且没有强腐蚀性,适宜采用;答案选D。


科目:高中化学 来源: 题型:
【题目】F是一种橡胶,具有高弹性、耐寒性和耐磨损性能,X是一种合成树脂,二者的工业合成路线如下图所示。

已知:I.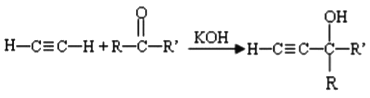
II.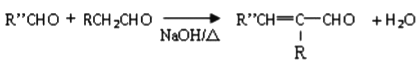
(-R、-R′、-R′′表示可能相同或可能不同的原子或原子团)
(1)①反应的类型为_______。
(2)E的系统命名为________,其分子中最多有______个原子共平面。
(3)A分子中核磁共振氢谱的吸收峰只有1组,C的结构简式为_______。
(4)关于D的说法不正确的是______。
a.分子式为C5H12O
b.可被氧化成醛类
c.官能团含有碳碳双键和羟基
d.能够发生加成、消去、取代、聚合等反应
(5)H存在顺反异构,其反式结构简式为_____, H的同分异构体中属于芳香族化合物的共有_______种。
(6)B与FeCl3溶液作用显紫色。B与G在一定条件下反应生成X的化学方程式为________。
(7)已知: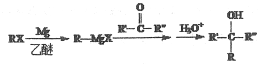 (R、R′、R′′代表烃基或氢)
(R、R′、R′′代表烃基或氢)
结合本题信息,以乙醇为原料,无机试剂任选,写出合成CH3CH=CHCH(OH)CH2CH3的路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、NO、NH3是中学中常见的几种气体。
(1)质量之比为32:7:30的三种气体SO2、CO、NO,分子数之比为_______,氧原子数之比为_______。
(2)标准状况下,4.25g NH3的体积为______L,它与标准状况下_____L H2S含有相同数目的氢原子。
(3)将标准状况下6.72L SO2通入1L 0.6mol/L NaOH溶液中,左后得到的溶质是______,该溶质的物质的量浓度为________mol/L(忽略通入气体后溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。请回答下列问题:
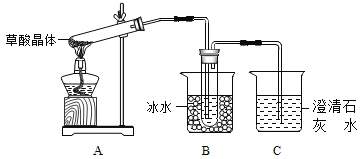
(1)甲组同学按照上图所示装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是_______,由此可知草酸晶体分解的产物中有__________。装置B的主要作用是_____________。
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
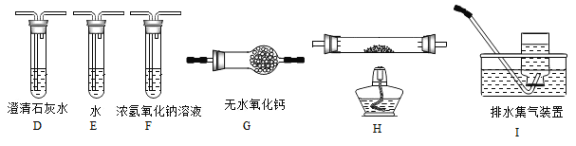
①乙组同学的实验装置中,依次连接的合理顺序为A、B_____________。
装置H反应管中盛有的物质是_________________。
②能证明草酸晶体分解产物中有CO的现象是_________________。
(3)设计实验证明:
①草酸的酸性比碳酸的强_____________。
②草酸为二元酸___________________。
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4溶液、MnO2氧化,锰元素被还原为+2价。KMnO4溶液和草酸钠溶液在稀硫酸中反应的离子方程式为:________________。
实验室常用固体草酸钠测定KMnO4溶液的浓度。准确称取0.2000g草酸钠,放入锥形瓶中,加入100mL稀硫酸溶解,用配制好的KMnO4溶液滴定,三次重复实验消耗KMnO4溶液的体积分别是16.02mL、16.00 mL、16.01 mL,则KMnO4溶液的物质的量浓度的计算式是:c(KMnO4)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟
B. 该反应利用了Cl2的强氧化性
C. 该反应中HCl是氧化产物
D. 生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,调节2.0×10-3 mol/L氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。请结合图中信息回答下列问题:
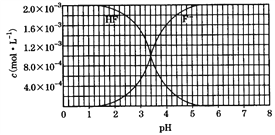
(1)HF电离平衡常数的表达式:Ka=_________。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,c(F-)∶c(HF) =_______。HF 的电离常数值为_______。
(2)将4.0×10-3mol/L的HF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生:
______________________________。[已知Ksp(CaF2)=1.5×10-10 ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是_________。
(2)易拉罐溶解过程中主要反应的化学方程式为_______________;滤液A中的某种离子与NH4+,HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为___________。
(3)Al(OH)3在水中存在两种电离方式,其中:Al(OH)3(aq)![]() AlO2-+H+(aq)+H2O(l) Ka=2.0×10-13(25℃),则25℃时Al(OH)3与NaOH溶液反应的平衡常数K=________________(列出含Kw、Ka的表达式并计算)
AlO2-+H+(aq)+H2O(l) Ka=2.0×10-13(25℃),则25℃时Al(OH)3与NaOH溶液反应的平衡常数K=________________(列出含Kw、Ka的表达式并计算)
(4)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S![]() K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为____________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为____________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是( )
A.生成的氢气中只有D2B.生成的氢气中只含有H2
C.生成的氢气中含有H2、HD、D2D.以上判断都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com