
 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.分析 (1)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)A、用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高;
B.量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;Ⅱ.(1)根据中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台;
D.装置保温、隔热效果差,测得的热量偏小;
(3)中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台;
(4)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时溶液颜色由红色突变为无色;
(5)根据滴定管的结构和精确度以及测量的原理:NaOH+HCl=NaCl+H2O来解答;
(6)根据c(待测)=$\frac{c标准×V标准}{V待测}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,则稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故正确;
B、量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故错误;
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,故正确;
D.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故正确;
故选ACD;
(3)中和滴定实验的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台,实验中不必用到的是容量瓶,故选B.
(4)酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,滴定终点时溶液颜色由红色突变为无色,且半分钟内不褪色,且半分钟内不褪色,
故答案为:锥形瓶中溶液颜色的变化;滴加最后一滴盐酸,溶液由红色变成无色,且半分钟不变色;
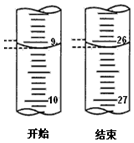
(5)起始读数为9.10mL,终点读数为26.10mL,消耗的盐酸溶液的体积为17.00mL,用c(HCl)=0.1mol/L的盐酸标定25mL的氢氧化钠溶液,发生NaOH+HCl=NaCl+H2O,则满足V(HCl)×c(HCl)=V(NaOH)×c(NaOH),c(NaOH)=$\frac{0.1mol/L×10.00mL}{25mL}$≈0.068mol/L;
故答案为:0.068;
(6)A、锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c标准×V标准}{V待测}$可知,测定c(NaOH)无影响,故错误;
B、碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液,待测液的浓度偏小,物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c标准×V标准}{V待测}$可知,测定c(NaOH)偏小,故正确;
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c标准×V标准}{V待测}$可知,测定c(NaOH)偏大,故错误;
D、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c标准×V标准}{V待测}$可知,测定c(NaOH)偏低,故正确;
故答案为:BD.
点评 本题主要考查了中和滴定操作与误差分析,侧重于学生的分析、实验和计算能力的考查,难度不大,注意中和滴定的原理、酸碱中和时H+的物质的量与OH-离子的物质的量相等,把握误差分析.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO21 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与氧化铁在加热条件下的反应 | |
| B. | 灼热的碳与二氧化碳反应 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 碳与水高温条件下制取水煤气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水、糖水、冰水都属于混合物 | |
| B. | 烧碱、火碱、消石灰都属于碱 | |
| C. | KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸 | |
| D. | 溶液、胶体、浊液都属于稳定的分散系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com