
【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是_________________。
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C-C | C-H | H-H | C-O | C=O | O-H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
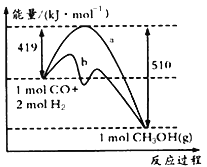
请回答下列问题:
①如图中曲线a到曲线b的措施是_______________。
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池正极的电极反应式为____________________。
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为_____________。
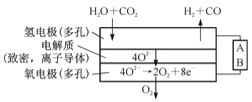
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(70-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由右图可知A为直流电源的 (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:____________。
【答案】(1)①2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) △H=-316 kJ·mol-1
②提高甲醇的转化率(2分)
(2)①使用 加入催化剂 ②1097(3)①O2+2H2O -4e-=4OH-②3.2 g
(4)H2O+2e-=H2↑+O2-
【解析】
试题分析:(1)①已知:⑴CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
⑵2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
根据盖斯定律可知⑴×2+⑵即可得到CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) △H=-316 kJ·mol-1。
②向反应器中通入适当过量的氧气,使平衡向正反应方向进行,提高甲醇的转化率。
(2)①图中曲线a到曲线b降低了反应的活化能,其其措施是加入了催化剂。
②反应热=反应物中键能之和-生成物中键能之和,则根据方程式可知x+2×436-3×413-358-463=419-510,解得x=1097。
(3)①电池正极得到电子,则正极是氧气放电,其电极反应式为O2+2H2O -4e-=4OH-。
②电解一段时间后,两极收集到相同体积(相同条件下)的气体,这说明阴极上除了铜离子放电外,还有氢离子放电,铜离子的物质的量是0.1mol,设气体的物质的量是xmol,则根据电子得失守恒可知0.1×2+2x=4x,解得x=0.1,所以氧气的质量=0.1mol×32g/mol=3.2g。
(4)A电极产生氢气和CO,所以该电极是阴极,因此A电极是负极,水得到电子产生氢气的电极反应式为H2O+2e-=H2↑+O2- 。


科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究过氧化氢的性质。回答下列问题:
(1)甲组同学拟配制5%的H2O2溶液,他们先从文献查得H2O2的稳定性与pH的关系如图所示。则配制H2O2溶液时应滴入几滴_____________(填“稀硫酸”或“氨水”)。

(2)乙组同学向一支试管中加入2mLFeCl2溶液,再滴入几滴甲组同学配制的H2O2溶液,最后滴人KSCN溶液,溶液变红,H2O2与Fe2+发生反应的离子方程式为_________________;另取一支试管,向其中加入SO2与BaCl2混合溶液2mL,再滴入几滴5%的H2O2溶液,现象是_____________。
(3)丙组同学取2mLKMnO4溶液于试管中,向其中滴几滴5%的H2O2溶液,发现溶液逐渐褪色,该反应中的还原剂是____________(填化学式)。
(4)丁组同学向一支试管中加入2mL5%的H2O2溶液、0.5mL乙醚、1mLlmol/LH2SO4溶液和3~4滴0.5mol/LK2Cr2O7溶液,发现上层乙醚层为蓝色(CrO5的乙醚溶液),一段时间后上层蓝色消失。

①乙醚的主要作用是____________。
②开始时,H2O2溶液与K2Cr2O7酸性溶液反应生成CrO5,该反应属于____________(填“氧化还原”或“非氧化还原”)反应。
③一段时间后,乙醚层中的CrO5与水相中的H+作用生成Cr3+并产生无色气泡,从而使蓝色逐渐消失,该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2 、KCl 中的一种或几种。将该白色固体少量溶于水中,得到无色透明溶液,取100 mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:

(1)由此可知,该白色固体中一定含有 ,一定没有 。
(2)实验过程中发生有关反应的化学方程式: 。
(3)请设计实验证明可能有的物质是否存在 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
①碳元素参与生物体内所有化合物的组成
②地球上的生命是在碳元素的基础上建立起来的
③碳元素是各种大分子化合物中数量最多的元素
④碳元素是组成生物体有机化合物的最基本元素
A. ②③④ B. ③④ C. ①②④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的量的有关公式计算(注:(2)(3)(4)计算结果保留小数点后两位)
(1)3.01×1023个NH4+,其质量为 g。
(2)欲配制1L 0.2 mol.L-1的盐酸溶液,需标准状况下HCl的体积为 L。
(3)现将50 mL密度为1.84 g/cm3,质量分数为98.0 %的浓硫酸,稀释至250 mL,则稀释后,溶液的物质的量浓度为 。
(4)19克MgCl2中含有离子数目 。
(5)所含原子数相等的甲烷和氨气(NH3)的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
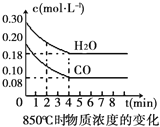
(1)0~4min的平均反应速率v(CO)=___________molL-1min-1.
(2)该条件下,此反应的平衡常数K=___________(写表达式).
(3)该反应平衡时CO的转化率为________________。
(4)能判断该反应达到化学平衡状态的依据是______________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
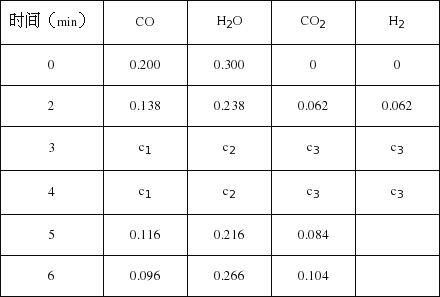
① c1数值___________0.08molL-1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________________,表中5min~6min之间数值发生变化,可能的原因是_______________。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
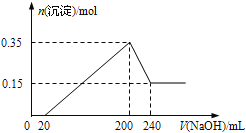
A.Mg和Al的总质量为8g B.硫酸的物质的量浓度为5mol/L
C.NaOH溶液的物质的量浓度为5mol/L D.生成的H2在标准状况下的体积为11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com