
【题目】C、H、O、N、P、S这6种元素是组成细胞的主要元素,它们占细胞鲜重的百分比正确的是
A. C>H>O>N>P>S B. O>C>H>N>P>S
C. C>O>H>N>P>S D. O>H>C>N>S>P
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】恒温下,在容积固定的密闭容器中发生如下反应:aX(S)+bY(g) ![]() cZ(g)+dW(g) △H>0,下列叙述正确的是
cZ(g)+dW(g) △H>0,下列叙述正确的是
A. 平衡后继续充入X,正反应速率增大
B. 平衡后继续充入X,W的体积分数增大
C. 平衡后通入少量Y,平衡右移,△H增大
D. 恒温,恒容下充入1mol稀有气体He,Z的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 5.6g铁与稀硝酸反应,转移电子数一定为0.3NA
B. 密闭容器中,1molN2和3molH2催化反应后分子总数大于2NA
C. 3.2gN2H4中含有共用电子对的总数为0.6NA
D. 室温下,pH=1的H3PO4溶液中,含有0.1NA个H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“玉兔”号月球车用![]() Pu作为热源材料。下列关于
Pu作为热源材料。下列关于![]() Pu的说法正确的是( )
Pu的说法正确的是( )
A.![]() Pu与
Pu与![]() 互为同位素
互为同位素
B.![]() Pu与
Pu与![]() Pu具有相同的中子数
Pu具有相同的中子数
C.![]() Pu与
Pu与![]() U具有完全相同的物理性质和化学性质
U具有完全相同的物理性质和化学性质
D.![]() Pu与
Pu与![]() Pu具有相同的电子层结构
Pu具有相同的电子层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
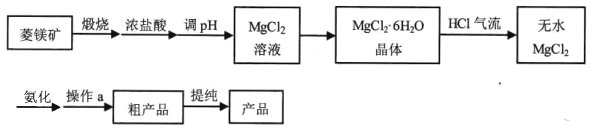
其中氨化过程装置示意图如下:
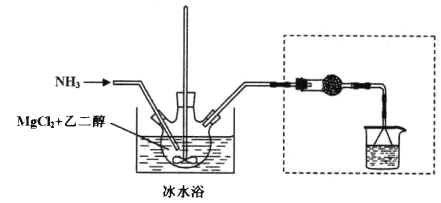
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为___________,该电池反应物中涉及第二周期的元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(2)H3PO4和H2CO3中P和C原子的杂化方式_____(填“相同”或“不相同”)。PO43-的空间结构为___________。
(3)石墨可用作锂离子电池的负极材料,Li+嵌人石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=___________;若每个六元环都对应一个L i+,则化学式为___________。

(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为___________,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________(用最简整数比表示)。假设晶胞边长为a nm,则两个最近的Li+的距离为___________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是
混合物 | 酸 | 盐 | 化合物 | |
A | CuSO4·5H2O | H2SO4 | NaCl | 盐酸 |
B | 碱石灰 | 醋酸 | 生石灰 | Na2O |
C | KNO3晶体 | NH4Cl | Cu2(OH)2CO3 | NaOH |
D | 澄清石灰水 | HNO3 | NaHSO4 | NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com