
| A. | 维生素C不具有还原性 | |
| B. | 上述过程中砷元素发生还原反应 | |
| C. | 上述过程中+5价砷类物质作还原剂 | |
| D. | 1 mol+5价砷完全转化为+3价砷,共失去2 mol电子 |
分析 由对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物,则砷元素的化合价降低,+5价砷类化合物为氧化剂,维生素C中某元素的化合价升高,则维生素C为还原剂,以此来解答.
解答 解:A、维生素C中某元素的化合价升高,则维生素C为还原剂,具有还原性,故A错误;
B、砷元素的化合价降低,+5价砷类化合物为氧化剂,发生还原反应,故B正确;
C、+5价砷类化合物为氧化剂,故C错误;
D、1mol+5价砷完全转化为+3价砷,共得到1mol×(5-3)=2mol,故D错误;
故选B.
点评 本题考查氧化还原反应,明确氧化剂、还原剂中元素的化合价变化是解答本题的关键,并注意信息的利用来解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 配制该溶液时,将FeBr2粉末溶解在HBr溶液中,并加入少量铁钉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液:Na+、NH4+、SO32-、NO3- | |
| B. | 滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- | |
| C. | 无色透明溶液:MnO4-、SO42-、K+、NO3- | |
| D. | 强碱性的溶液:Al3+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2CO(g)+1O2(g)═2CO2(g)△H=-566 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池充电时电池反应为C6Li+Li1-xMO2═LiMO2+C6Li1-x | |
| B. | 电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量大 | |
| C. | 锂离子电池放电时电池内部Li+向负极移动 | |
| D. | 锂离子电池充电时阴极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面涂油漆可增强其抗腐蚀性 | |
| B. | PM2.5是指大气中直径接近2.5×10-6m的颗粒,分散在空气中形成胶体 | |
| C. | 大量燃烧煤、石油等化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
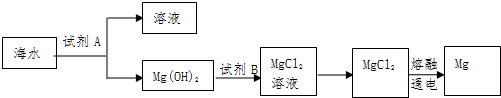
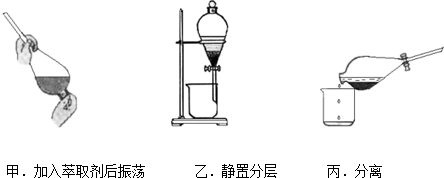
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com