
A.![]()
B.![]()
C.![]()
D.![]()
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)X元素位于周期表中第____________族(用字母表示)。
(2)X、Y、Z三种元素形成的单质中,氧化性最弱的是____________________(填化学式)。
(3)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为_________________________________。
(4)a溶液的pH___________7(填“>”“<”或“=”),用离子方程式解释为__________________,若在a溶液中加入少量镁粉,可观察到的现象是_________________________________。
(5)取pH=0的W的最高价氧化物对应水化物的溶液100.0 mL于某容器中,加入
若设Cu、Ag的物质的量分别为x、y。欲求算x、y的值,可列出下列计算式:
Ⅰ.64x+108y=0.90,该计算式是依据_____________________________________关系列出的;
Ⅱ.2x+y=1 mol·L -1×
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜是一种重要的硫酸盐,在工农业生产中有着重要的应用。
回答下列问题:
(1)写出基态Cu2+的核外电子排布式 。
(2)SO42-中S原子的杂化轨道类型是 ;与SO42-互为等电子体的一种微粒是 。
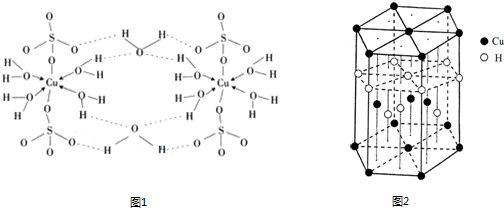
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:
①胆矾中含有的粒子间作用力是 (填序号)。
a. 离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
②在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中键的数目为 。
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则氧的配位数是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:填空题
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: 。
(2)PO43—的空间构型是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是 。
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
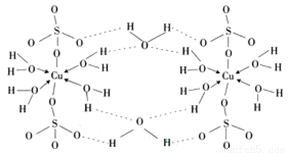
a.离子键 b.极性键 c.金属键
d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为 。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。
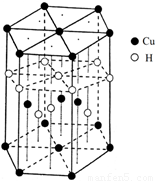
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省、海门中学、天一中学高三上学期联考化学试卷 题型:填空题
硫酸铜是一种重要的硫酸盐,在工农业生产中有着重要的应用。
回答下列问题:
(1)写出基态Cu2+的核外电子排布式 。
(2)SO42-中S原子的杂化轨道类型是 ;与SO42-互为等电子体的一种微粒是 。
(3) 胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4
·H2O,其结构示意图如下:
胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4
·H2O,其结构示意图如下:

①胆矾中含有的粒子间作用力是 (填序号)。
a. 离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
②在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中 键的数目为
。
键的数目为
。
③胆矾受热分解得到铜的某种氧化物,其晶胞结构如图所示,则氧的配位数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com