
| 选项 | 操作和现象 | 结论 |
| A | 其他条件不变,缩小H2(g)+I2(g)?2HI(g)的平衡体系的容器容积,气体颜色变深 | 增大压强,平衡逆向移动 |
| B | 分别将乙烯与SO2通入酸性KMnO4溶液中,KMnO4溶液均褪色 | 两种气体使酸性KMnO4溶液褪色的原理不相同 |
| C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴管内有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
| D | 25℃时,分别测定等物质的量浓度的NaCN溶液和NaF溶液的pH,前者pH大 | 酸性:HCN>HF |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该反应为气体体积不变的反应,压强不影响化学平衡;
B.两种气体使酸性KMnO4溶液褪色的原理相同,都发生氧化还原反应;
C.初读数时尖嘴管内有气泡,末读数时气泡消失,部分溶液填充气泡;
D.二者都是强碱弱酸盐,溶液pH越大,说明盐的水解程度越大,则对应酸的酸性越弱.
解答 解:A.反应H2(g)+I2(g)?2HI(g)为气体体积不变的可逆反应,增大压强后平衡不一定,故A错误;
B.乙烯与SO2都能够被酸性高锰酸钾溶液氧化,从而使酸性高锰酸钾溶液褪色,褪色原理相同,故B错误;
C.用滴定管量取20.00mL稀硫酸,初读数时尖嘴管内有气泡,末读数时气泡消失,由于部分溶液填充气泡,导致量取的稀硫酸体积小于20.00mL,故C正确;
D.25℃时,分别测定等物质的量浓度的NaCN溶液和NaF溶液的pH,前者pH大,说明NaCN的水解程度较大,根据越弱越水解可知,HCN的酸性较弱,即酸性:HCN<HF,故D错误;
故选C.
点评 本题考查 化学实验方案的评价,题目难度不大,涉及化学平衡及其影响、氧化还原反应、盐的水解原理、中和滴定等知识,明确常见化学实验基本操作方法为解答关键,注意掌握盐的水解原理、化学平衡及其影响,试题培养了学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | A的能量一定高于C | |
| B. | 该反应为放热反应,故不必加热就一定能发生 | |
| C. | B的能量一定高于D | |
| D. | A和B的总能量一定高于C和D的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醛与银氨溶液反应:CH3CHO+2[Ag(NH3)2]OH $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 溴乙烷水解生成乙醇:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH3CH2OH+Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤和装置 | |
| A | 探究温度对反应速率的影响 | 不同温度下,分别取同体积0.1mol•L-1KI溶液,向其中匀先加入淀粉溶液3滴,再各加入0.1mol•L-1硫酸5滴,并同时记录溶液出现蓝色的时间 |
| B | 配制100mL1.0mol•L-1NaOH溶液 | 向100mL容量瓶中加入4.0gNaOH固体,加水到刻度线 |
| C | 验证牺牲阳极的阴极保护法 | 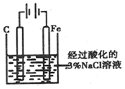 往铁电极附近滴加铁氯化钾溶液 |
| D | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸均能与NaOH溶液反应 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | C4H8Cl2有9种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
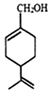
| A. | 分子式为C10H16O | |
| B. | 紫苏醇为芳香族化合物 | |
| C. | 环上的一氯取代物有四种 | |
| D. | 使酸性高锰酸钾溶液和溴水褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 400℃时,生成的产物有N2、NO、H2O | |
| B. | 800℃时,反应的化学方程式是:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{800℃}$ 4NO+6H2O | |
| C. | 400℃-800℃间,Pt-Rh合金对N2的吸附力逐渐减弱 | |
| D. | 800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com