
【题目】在两份相同的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
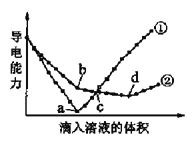
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. 曲线①的c点和曲线②的c点所代表的溶液酸碱性相同
D. a、d两点对应的溶液均显中性
【答案】C
【解析】
A.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,第一个反应恰好完成的时候,溶液中不存在离子,导电能力近似为0,根据图知,曲线①在a点溶液导电能力接近0,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,故A正确;
B.根据图知,b点反应为NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,则b点溶液溶质为NaOH,所以b点溶液中大量存在的离子是Na+、OH﹣,故B正确;
C.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4,显然①中c点显酸性,②中c点显碱性,故C错误;
D.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4,水和硫酸钠溶液都呈中性,故D正确;
故答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知水在25℃和100℃时,其电离平衡曲线如下图所示:
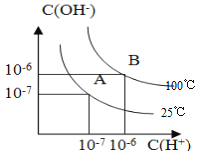
(1)25℃时,水的离子积为_________________
(2)若向25℃的水中滴加少量冰醋酸,c(H+)_____________(填“变大”、“变小”或“不变”),醋酸的电离方程式为________________________
(3)若向100℃的水中加入少量Ag2CrO4固体,一段时间后,达到Ag2CrO4的沉淀溶解平衡,该温度下溶度积的表达式Ksp (Ag2CrO4)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
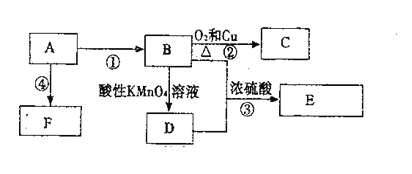
(1)A的电子式为________________,C的名称________________,F的结构简式________________。
(2)D分子中的官能团名称是________________,请设计一种实验来验证D物质存在该官能团的方法是____________________________。
(3)写出下列反应的化学方程式并指出反应类型:③________________,反应类型________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”。研究含氮和含硫化合物的性质在工业生产和环境保护中有重要意义。
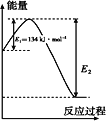
(1)制备硫酸可以有如下两种途径:
2SO2(g)+O2(g)2SO3(g)ΔH=-198 kJ· mol-1
SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1
若CO的标准燃烧热为 283 kJ· mol-1,则1 mol NO2和1 mol CO反应生成CO2和NO的能量变化示意图中E2=________kJ· mol-1。
(2)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,用NaOH溶液吸收SO2。当溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为_______________。
(3)连二亚硫酸钠(Na2S2O4)具有强还原性,废水处理时可在弱酸性条件下加入亚硫酸氢钠电解产生连二亚硫酸根,进而将废水中的HNO2还原成无害气体排放,连二亚硫酸根氧化为原料循环电解。产生连二亚硫酸根的电极反应式为________________,连二亚硫酸根与HNO2(HNO2的电离常数为Ka=5.1×10-4)反应的离子方程式为________________________________。
(4)锅炉烟道气含CO、SO2,可通过如下反应回收硫:2CO(g)+SO2(g)![]() S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
S(l)+2CO2(g)。某温度下在2 L恒容密闭容器中通入2 mol SO2和一定量的CO发生反应,5 min后达到平衡,生成1 mol CO2。
①其他条件不变时,随着温度的升高,SO2的平衡转化率变化如图A,请解释其原因________________________________。(已知硫的沸点约是445°C)
②保持其他条件不变,第8分钟时,将容器体积迅速压缩至1 L,在10分钟时达到平衡,CO的物质的量变化了1 mol。请在图B中画出SO2浓度6~11分钟的变化曲线。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述中正确的是
A. 苯与溴水混合,振荡静置后,上层液体无色,下层液体为橙红色
B. (CH3)3CCH2Br在NaOH的醇溶液中加热可发生消去反应
C. 乙烯、丙烯、聚乙烯等均能使溴水褪色,而甲烷、乙烷等则不能
D. 等质量的C2H4、聚乙烯( ![]() )分别完全燃烧,消耗O2的物质的量相同
)分别完全燃烧,消耗O2的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示)。向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应。在此实验过程中:
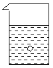
(1)烧杯里观察到的实验现象有:① ____,② ______。
(2)写出实验过程中反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 某弱酸的酸式盐NaHA溶液中一定有:c(OH﹣)+2c(A2﹣)=c(H+)+c(H2A)
B. 0.2 molL﹣1 CH3COONa溶液与0.1 molL﹣1盐酸等体积混合后的酸性溶液中:c(CH3COO﹣)>c(CH3COOH)>c(Cl﹣)>c(H+)
C. 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO, 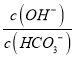 溶液中增大
溶液中增大
D. 0.1 molL﹣1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3H2O)+c(Fe2+)=0.3 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合的溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
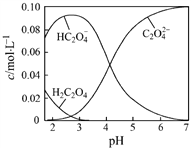
A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B. pH=7的溶液中:c(Na+)= 2c(C2O42–)
C. c(HC2O4–)= c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+ c(HC2O4–)
D. c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com