
分析 ①FeCl3在溶液中分三步水解:铁离子逐个结合水电离出的氢氧根离子,促进水电离平衡正向进行,平衡常数表达式中固体和纯液体不写入;
②第一步水解显示酸性会抑制第二步水解.
解答 解:①FeCl3在溶液中分三步水解:铁离子逐个结合水电离出的氢氧根离子,促进水电离平衡正向进行,
FeCl3在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+ K1
Fe(OH)2++H2O?Fe(OH)2++H+ K2
Fe(OH)2++H2O?Fe(OH)3+H+K3.
平衡常数表达式中固体和纯液体不写入;
第三步的平衡常数为:K3=$\frac{c({H}^{+})}{c(Fe(OH{)_{2}}^{-})}$,
故答案为:Fe(OH)2++H2O?Fe(OH)3+H+;$\frac{c({H}^{+})}{c(Fe(OH{)_{2}}^{-})}$;
②第一步水解显酸性,水解生成的氢离子会抑制第二步水解,K1和K2的大小关系是K1>K2,
故答案为:K1>K2,第一步水解会抑制第二步水解.
点评 本题考查了盐类水解的原理分析,平衡常数书写,注意电离分步进行时逐步减弱,题目较简单.


科目:高中化学 来源: 题型:解答题
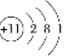 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
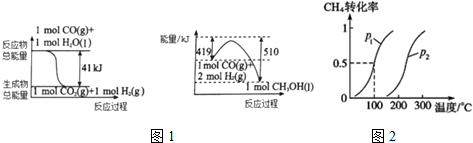
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸案中对剧毒的氯化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氧化铵固体反应,高温下铝与氧化铁反应都是吸热反应 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
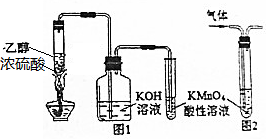
| A. | 用图1所示装置制取乙烯并验证其某些性质 | |
| B. | 用图2装置除去甲烷中的乙烯 | |
| C. | 在坩埚中灼烧CuSO4•5H2O晶体以除去结晶水 | |
| D. | 0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜反应,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 0.70 | 23.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
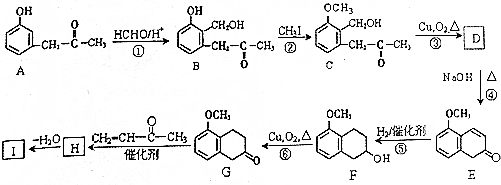
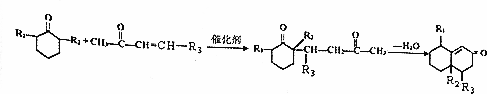
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2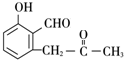 +2H2O.
+2H2O.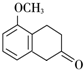 +
+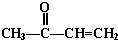 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$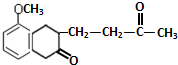 .
.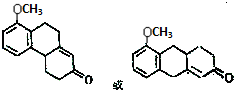 .
.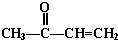 的流程图
的流程图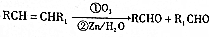 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com