
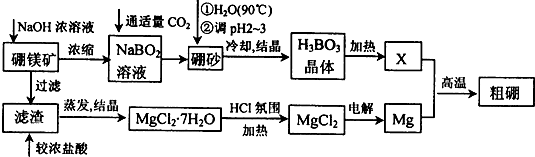
分析 硼镁矿加入氢氧化钠浓溶液,过滤得到滤渣为氢氧化镁,滤渣中加入浓盐酸溶解,通过蒸发浓缩得到氯化镁结晶水合物,防止氯化镁水解,在氯化氢气流中加热得到氯化镁固体,电解熔融的氯化镁得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,加热得到B2O3.Mg与B2O3发生置换反应得到粗硼.
(1)根据化合价代数和为0计算硼砂中B的化合价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ;
(2)氯化镁容易水解生成氢氧化镁,HCl可以抑制氯化镁水解;惰性电极电解MgCl2溶液,阴极发生还原反应,氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀;
(3)正极发生还原反应,过氧化氢在正极获得电子生成水;根据pH变化计算氢离子浓度变化,结合电池反应式计算镁离子浓度;pH=6时,计算浓度积Qc,与溶度积常数比较判断是否生成氢氧化镁沉淀;
(4)由原子守恒及给出的离子方程式,可得关系式:2B~2BI3~3I2~6Na2S2O3,根据关系式计算.
解答 解:硼镁矿加入氢氧化钠浓溶液,过滤得到滤渣为氢氧化镁,滤渣中加入浓盐酸溶解,通过蒸发浓缩得到氯化镁结晶水合物,防止氯化镁水解,在氯化氢气流中加热得到氯化镁固体,电解熔融的氯化镁得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,加热得到B2O3.Mg与B2O3发生置换反应得到粗硼.
(1)硼砂的化学式为Na2B4O7•10H2O,钠元素化合价为+1价,氧元素化合价-2价,根据化合价代数和为0,可知硼元素化合价为+3价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3,
故答案为:+3;B4O72-+2H++5H2O=4H3BO3;
(2)加热MgCl2•7H2O时,氯化镁水解生成氢氧化镁,在HCl氛围中加热可以抑制MgCl2的水解;
惰性电极电解MgCl2溶液,阴极发生还原反应,氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,阴极反应式为:2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
故答案为:抑制MgCl2的水解;2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
(3)正极发生还原反应,过氧化氢在正极获得电子生成水,正极反应式H2O2+2H++2e-=2H2O;若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,由反Mg+H2O2+2H+═Mg2++2H2O,可知Mg2+离子浓度=0.045mol/L;
Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=6时,c(OH-)=10-8mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-16mol/L=4.5×10-18<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;
故答案为:H2O2+2H++2e-=2H2O;0.045 mol•L-1;没有;
(4)硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,根据关系式:2B~2BI3~3I2~6Na2S2O3,可知n(B)=$\frac{1}{3}$n(S2O32-)=0.0018mol,硼的质量为10.81g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:$\frac{0.01944g}{0.020g}$×100%=97.2%,
故答案为:97.2%.
点评 本题考查物质制备工艺流程,涉及对操作的分析评价、电解原理与计算、溶度积有关计算、物质含量测定等,整个问题中只有(1)中调节pH与工艺流程有关,其问题就能无关,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 6 mol/L | B. | 3 mol/L | C. | 2.25mol/L | D. | 1.13 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | KCl | C. | CO(NH2)2 | D. | KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
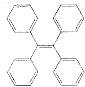 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有4种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
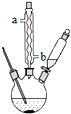 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
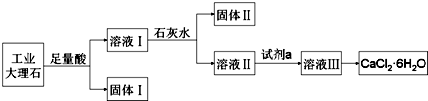
| A. | 固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为AlO2- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O产品的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | (C6H10O5)n 可表示淀粉或纤维素 | |
| B. | 反应②化学方程式为 C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑ | |
| C. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| D. | 反应③和④都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
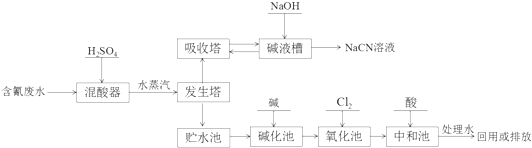
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com