
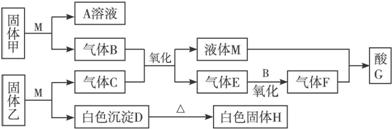
请按要求回答:
(1)写出固体甲和M反应的化学方程式_____________________________。
(2)若C是酸性气体,则酸G的化学式为____________,G溶液与H反应的离子方程式为____________________________________。
(3)若C是碱性气体,且D不溶于A溶液,则固体乙与M反应的化学方程式为________________________。
(1)2Na2O2+2H2O====4NaOH+O2↑
(2)H2SO4 6H++Al2O3====2Al3++3H2O
(3)Mg3N2+6H2O====3Mg(OH)2+2NH3
解析:根据已知条件,可推导如下:
若C为酸性气体,则甲为Na2O2,M为水,乙为Al2S3,B为O2,C为H2S,D为Al(OH)3,E为SO2,F为SO3,G为H2SO4;
若C为碱性气体,则乙为Mg3N2,C为NH3,D为Mg(OH)2,H为MgO,E为NO,F为NO2,G为HNO3。
有关反应方程式:甲+M:2Na2O2+2H2O====4NaOH+O2↑
G+H:6H++Al2O3====2Al3++3H2O
乙+M:Mg3N2+6H2O====3Mg(OH)2+2NH3↑


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
(15分) I 在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。
II如图表示的是生产酸G的工业流程:
(1)乙设备的名称为 固体乙的化学式为 M分子的结构式为 。
(2)气体X的主要成分为 。
(3)写出设备甲中常见的化学反应 。
(4)白色沉淀D与G溶液反应的离子方程式为 。
(5)将2.24 L(标准状况下)E通入100mL2 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为____________ ___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为 当电解时转移2.4mol电子,制得金属 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为一常见金属,酸G是重要的化工产品和化工原料;固体H能够溶解在A溶液和酸G中,且H为良好的耐火材料(图中部分产物没有列出)。

(1)固体甲与液体M反应的方程式为______。A溶液与固体H反应的离子方程式为______。
(2)固体乙的化学式为_______。液体M的电子式为_______。
(3)反应①~⑦中属于氧化还原反应的为_______(填写反应序号)。
(4)若I与C的稀溶液不反应,只能与G的浓溶液在加热条件下反应,则反应⑦的化学方程式为_______。
(5)若由黄铁矿(FeS2)与气体B反应来生产气体E,且每生成1 mol E放出426.5 kJ的热量,该反应的热化学方程式为_______ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省卫辉市高三3月考试化学试卷 题型:填空题
.(12分)在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为常见金属,且I与G的稀溶液不反应,只能与G的浓溶液在加热条件下反应;酸G是重要的化工产品和化工原料;H为良好的耐火材料(图中部分产物没有列出)。
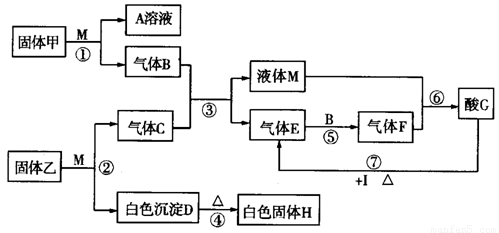 (1)固体甲的名称为__________,F的化学式为______________。
(1)固体甲的名称为__________,F的化学式为______________。
(2)反应①~⑦中属于氧化还原反应的是______________(填写反应序号)。
(3)工业废气中常含有气体E,为了充分利用资源、保护环境,目前应用最广泛的工业废气处理方法是石灰法。以生石灰为原料在吸收装置中与气体E反应的化学方程式为:
___________________________________________。
(4)反应⑦的化学反应方程式为_____________________________________________。
(5)已知工业上电解熔融的H冶炼金属单质X,向40.0g固体混合物中(仅含H、Fe2O3、SiO2),加入足量稀盐酸,分离得到12.0g固体;滤液中加入过量A溶液,分离得到21.4g固体;则此混合物中元素X的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源:2010年甘肃省高三第二次联合考试(理综)化学部分 题型:填空题
(15分) I 在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,酸G是重要的化工产品和化工原料;固体H能溶解在A和酸G且H为良好的耐火材料(图中部分产物没有列出)。

II如图表示的是生产酸G的工业流程:

(1)乙设备的名称为 固体乙的化学式为 M分子的结构式为 。
(2)气体X的主要成分为 。
(3)写出设备甲中常见的化学反应 。
(4)白色沉淀D与G溶液反应的离子方程式为 。
(5)将2.24 L(标准状况下)E通入100 mL2 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为____________ ___。
(6)电解熔融固体H可制得一种金属,则电解化学方程式为 当电解时转移2.4mol电子,制得金属 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com