
| A. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是AlCl3溶液 | |
| B. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4 | |
| C. | 若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液 | |
| D. | 若两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液 |
分析 A.若滴加的为氯化铝溶液,由于氯化铝少量,则不存在与氯化铝只生成沉淀的现象;
B.若滴加的是硫酸,氯化铝与硫酸没有明显现象,氢氧化钡与硫酸只生成硫酸钡沉淀;
C.少量氢氧化钡与氯化铝生成氢氧化铝沉淀、与碳酸氢铵反应生成碳酸钡沉淀和氨气,与硫酸反应生成硫酸钡沉淀;
D.两支试管中既产生沉淀又出现气体时,只能是氯化铝、氢氧化钡分别与碳酸氢铵反应.
解答 解:A.氯化铝与过量氢氧化钡反应生成偏铝酸根离子,与碳酸氢根离子反应生成氨气和二氧化碳气体,与硫酸无明显现象,所以若一支试管中只产生沉淀,一支试管中无明显现象时,滴定的不可能为AlCl3溶液,应该为硫酸,故A错误;
B.氢氧化钡与硫酸反应只生成沉淀,氯化铝与硫酸不反应,贴上去阿玉与硫酸反应生成气体,若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4,故B正确;
C.少量的氢氧化钡与氯化铝可以生成氢氧化铝沉淀,与硫酸反应生成硫酸钡沉淀,而与碳酸氢铵反应生成沉淀和气体,若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液,故C正确;
D.碳酸氢铵与氯化铝溶液发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,碳酸氢铵溶液与氢氧化钡溶液加热生成碳酸钡沉淀和氨气,所以当两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液,故D正确;
故选A.
点评 本题考查了物质检验与鉴别方案的设计,题目难度中等,明确常见元素及其化合物性质为解答关键,注意氯化铝与碳酸氢铵发生双水解反应的现象,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
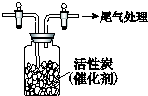 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
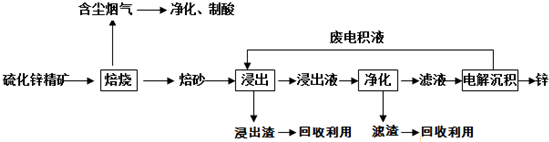
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
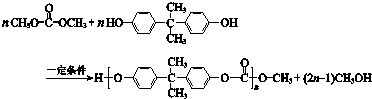
| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 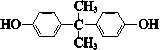 与 与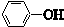 互为同系物 互为同系物 | |
| D. | 1 mol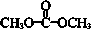 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | [NH4+]>[Cl-]>[OH-]>[H+] | B. | [NH4+]=[Cl-]>[H+]=[OH-] | C. | [Cl-]>[NH4+]>[OH-]>[H+] | D. | [OH-]>[NH4+]>[H+]>[Cl-] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量的铁粉反应,反应转移电子的数目为3NA | |
| B. | 室温时,足量Zn与浓硫酸反应共产生2mol气体,转移电子数为4NA | |
| C. | 7.8gNa2O2与足量水反应时转移电子数目为0.2NA | |
| D. | 1mol二氧化氮气体久置后在标准状况下的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0 6NA | |
| C. | 若由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2 NA | |
| D. | 常温下,1L 0. 1 mol/L NH4NO3溶液中的氢原子数为0.4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com