
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
分析 A.与量无关,二者反应生成氯化铁;
B.由电子守恒,亚铁离子全部被氧化,溴离子一半被氧化;
C.n(MnO4-):n(H2O2)=2:3,转移电子不守恒;
D.n(Fe):n[HNO3(稀)]=1:3,由反应可知,遵循电子、电荷守恒.
解答 解:A.与量无关,二者反应生成氯化铁,反应为3Cl2+2Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故A错误;
B.由电子守恒,亚铁离子全部被氧化,溴离子一半被氧化,反应为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故B错误;
C.n(MnO4-):n(H2O2)=2:3,发生的离子反应中转移电子不守恒,故C错误;
D.n(Fe):n[HNO3(稀)]=1:3,由4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O可知,遵循电子、电荷守恒,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
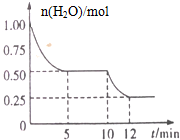 在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )| A. | 该反应的化学平衡常数表达式为K=c4(H2O)/c4(H2) | |
| B. | 5min时该反应的υ(正)等于9min时的υ(逆) | |
| C. | 0~5min内,υ(H2)=0.10mol/(L•min) | |
| D. | 10min时平衡发生移动可能是投入还原性铁粉引起 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe的质量为2.7g,Al的质量为2.8g | B. | Fe的质量为2.8g,Al的质量为2.7g | ||
| C. | Fe的质量为5.4g,Al的质量为5.6g | D. | Fe的质量为5.6g,Al的质量为5.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
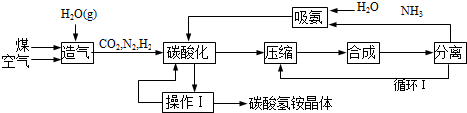
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
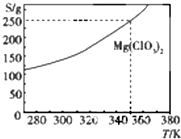 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ | |
| D. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖水 | B. | 石灰乳 | C. | 氢氧化铁胶体 | D. | 牛奶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液不分层,呈现黄色 | B. | 溶液分层,上层为水层,无色 | ||
| C. | 溶液分层,上层为苯层,紫色 | D. | 溶液分层,下层为苯层,紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
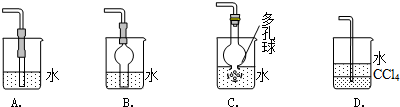
 如图所示,是原电池的装置图,请回答:
如图所示,是原电池的装置图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应:2Na2O2+2 H2O═4Na++4OH-+O2↑ | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2 OH-═2AlO${\;}_{2}^{-}$+H2↑ | |
| C. | 用小苏打治疗胃酸过多:CO32-+H+═CO2↑+H2O | |
| D. | 二氧化碳通入足量氢氧化钠溶液:CO2+OH-═CO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com