
øßĢśĖį¼Ų£ØK2FeO4£©ŹĒĢśµÄŅ»ÖÖÖŲŅŖ»ÆŗĻĪļ£¬¾ßÓŠ¼«ĒæµÄŃõ»ÆŠŌ”£
£Ø1£©½«ŹŹĮæK2FeO4ČܽāÓŚpH=4.74µÄČÜŅŗÖŠ£¬ÅäÖĘ³Éc(FeO42£)=1.0”Į10£3mol”¤L£µÄŹŌŃł£¬½«ŹŌŃł·Ö±šÖĆÓŚ20”ę”¢30”ę”¢40”ęŗĶ60”ęµÄŗćĪĀĖ®Ō”ÖŠ£¬²ā¶Øc(FeO42£)Ėꏱ¼ä±ä»ÆµÄ½į¹ūČēĶ¼1ĖłŹ¾”£
øĆŹµŃéµÄÄæµÄŹĒ_______________________£»FeO42£·¢Éś·“Ó¦µÄ”÷H____________0£ØĢī”°£¾”±”°£¼”±»ņ”°£½”±£©
£Ø2£©½«ŹŹĮæK2FeO4·Ö±šČܽāÓŚpH=4.74”¢7.00”¢11.50µÄĖ®ČÜŅŗÖŠ£¬ÅäÖĘ³Éc(FeO42£)=1.0”Į10£3 mol”¤L£µÄŹŌŃł£¬¾²ÖĆ£¬æ¼²ģ²»Ķ¬³õŹ¼pHµÄĖ®ČÜŅŗ¶ŌK2FeO4ijÖÖŠŌÖŹµÄÓ°Ļģ£¬Ęä±ä»ÆĶ¼Ļń¼ūĶ¼2£¬800minŹ±£¬ŌŚpH=11.50µÄČÜŅŗÖŠ£¬K2FeO4µÄÅØ¶Č±ČŌŚpH=4.74µÄČÜŅŗÖŠøߣ¬Ö÷ŅŖŌŅņŹĒ______________”£
£Ø3£©µē½ā·ØŹĒ¹¤ŅµÉĻÖʱøK2FeO4µÄŅ»ÖÖ·½·Ø”£ŅŌĢśĪŖŃō¼«µē½āĒāŃõ»ÆÄĘČÜŅŗ£¬Č»ŗóŌŚŃō¼«ČÜŅŗÖŠ¼ÓČėKOH£¬¼“ŌŚøßĢśĖįÄĘČÜŅŗÖŠ¼ÓČėKOHÖĮ±„ŗĶæÉĪö³öøßĢśĖį¼Ų£ØK2FeO4£©£¬ĖµĆ÷ ”£µē½āŹ±Ńō¼«·¢Éś·“Ӧɜ³ÉFeO42££¬øƵē¼«·“Ó¦Ź½ĪŖ______________”£
£Ø4£©ÓėMnO2”ŖZnµē³ŲĄąĖĘ£¬K2FeO4”ŖZnŅ²æÉŅŌ×é³ÉøßĢśµē³Ų£¬K2FeO4ŌŚµē³ŲÖŠ×÷Õż¼«²ÄĮĻ£¬Ęäµē¼«·“Ó¦Ź½ĪŖFeO42£+3e”„+4H2O”śFe(OH)3+5OH”„£¬ŌņøƵē³Ų×Ü·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_______________”£Ķ¼3ĪŖøßĢśĖį¼Ųµē³ŲŗĶøßÄܼīŠŌµē³Ų·ÅµēĒśĻߣ¬ÓÉ“ĖæÉµĆ³öµÄøßĢśĖį¼Ųµē³ŲµÄÓŵćÓŠ_______________________”¢________________________”£
£Ø1£©Ģ½¾æĪĀ¶Č¶ŌFeO42£Ó°Ļģ£ØĪĀ¶ČŌ½øߣ¬øßĢśĖį¼ŲŌ½²»ĪČ¶Ø£©£¬£¾£Øø÷2·Ö£©
£Ø2£©pH=11.50Ź±ČÜŅŗÖŠOH”„Ąė×ÓÅØ¶Č“ó£¬²»ĄūÓŚK2FeO4ÓėĖ®µÄ·“Ó¦ÕżĻņ½ųŠŠ”£ £Ø2·Ö£©
£Ø3£©Ķ¬ĪĀ¶ČĻĀ£¬øßĢśĖį¼ŲµÄČܽā¶Č±ČøßĢśĖįÄʵÄČܽā¶ČŠ” £Ø2·Ö£©
Fe+8OH”„£6e”„= FeO42£+4H2O £Ø2·Ö£©
£Ø4£©3Zn+2FeO42£+8H2O=3Zn(OH)2+2Fe(OH)3+4OH”„ £Ø2·Ö£©
·ÅµēŹ±¼ä³¤”¢¹¤×÷µēŃ¹ĪČ¶Ø £Øø÷1·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©ÓÉĶ¼1Źż¾ŻæÉÖŖ£¬ĪĀ¶ČŌ½øߣ¬ĻąĶ¬Ź±¼äÄŚFeO42£ÅØ¶Č±ä»ÆŌ½æģ£¬øßĢśĖį¼ŲČÜŅŗĘ½ŗāŹ±FeO42£ÅضČŌ½Š”£¬ĪĀ¶ČŌ½øßFeO42£ÅضČŌ½Š”£¬ÕżĻņ·“Ó¦ŹĒĪüČČ·“Ó¦£»
¹Ź“š°øĪŖ£ŗĪĀ¶ČŌ½øߣ¬øßĢśĖį¼ŲŌ½²»ĪČ¶Ø£Ø»ņĪĀ¶ČŌ½øߣ¬øßĢśĖį¼ŲÓėĖ®·“Ó¦µÄĖŁĀŹŌ½æģ£©£»£¾
£Ø2£©ÓÉĶ¼2Źż¾ŻæÉÖŖ£¬ČÜŅŗpHŌ½Š”£¬ĻąĶ¬Ź±¼äÄŚFeO42£ÅØ¶Č±ä»ÆŌ½æģ£¬øßĢśĖį¼ŲČÜŅŗĘ½ŗāŹ±FeO42£ÅضČŌ½Š”£®øßĢśĖį¼ŲŌŚĖ®ÖŠµÄ·“Ó¦ĪŖ4FeO42£+10H2O 4Fe(OH)3 +8OH£+3O2”ü£¬pH=11.50µÄČÜŅŗÖŠOH£Ąė×ÓÅØ¶Č“ó£¬Ź¹ÉĻŹöĘ½ŗāĻņ×óŅĘ¶Æ£¬FeO42£ÅضČŌö“󣬲»ĄūÓŚK2FeO4ÓėĖ®µÄ·“Ó¦ÕżĻņ½ųŠŠ£»
4Fe(OH)3 +8OH£+3O2”ü£¬pH=11.50µÄČÜŅŗÖŠOH£Ąė×ÓÅØ¶Č“ó£¬Ź¹ÉĻŹöĘ½ŗāĻņ×óŅĘ¶Æ£¬FeO42£ÅضČŌö“󣬲»ĄūÓŚK2FeO4ÓėĖ®µÄ·“Ó¦ÕżĻņ½ųŠŠ£»
¹Ź“š°øĪŖ£ŗpH=11.50µÄČÜŅŗÖŠOH£Ąė×ÓÅØ¶Č“ó£¬Ź¹ÉĻŹöĘ½ŗāĻņ×óŅĘ¶Æ£¬²»ĄūÓŚK2FeO4ÓėĖ®µÄ·“Ó¦ÕżĻņ½ųŠŠ£»
£Ø3£©ŅŌĢśĪŖŃō¼«µē½āĒāŃõ»ÆÄĘČÜŅŗ£¬Č»ŗóŌŚŃō¼«ČÜŅŗÖŠ¼ÓČėKOH£¬¼“ŌŚøßĢśĖįÄĘČÜŅŗÖŠ¼ÓČėKOHÖĮ±„ŗĶæÉĪö³öøßĢśĖį¼Ų£ØK2FeO4£©£¬ĖµĆ÷Ķ¬ĪĀ¶ČĻĀ£¬øßĢśĖį¼ŲµÄČܽā¶Č±ČøßĢśĖįÄʵÄČܽā¶ČŠ”£»Ńō¼«ŹĒĢśŹ§µē×ÓŌŚ¼īŠŌČÜŅŗÖŠ·¢ÉśŃõ»Æ·“Ӧɜ³ÉFeO42££»µē¼«·“Ó¦ĪŖ£ŗFe+8OH”„-6e”„=FeO42£+4H2O£»
¹Ź“š°øĪŖ£ŗĶ¬ĪĀ¶ČĻĀ£¬øßĢśĖį¼ŲµÄČܽā¶Č±ČøßĢśĖįÄʵÄČܽā¶ČŠ”£»Fe+8OH”„-6e”„=FeO42£+4H2O£»
£Ø4£©Ōµē³ŲµÄøŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬Õż¼«µē¼«·“Ó¦Ź½ĪŖ£ŗ¢ŁFeO42£+3e”„+4H2O”śFe(OH)3 +5OH”„£»øŗ¼«µē¼«·“Ó¦ĪŖ£ŗ¢ŚZn-2e£+2OH£=Zn(OH)2£»ŅĄ¾Żµē¼«·“Ó¦µÄµē×ÓŹŲŗć£¬¢Ł”Į2+¢Ś”Į3ŗĻ²¢µĆµ½µē³Ų·“Ó¦ĪŖ£ŗ3Zn+2FeO42£+8H2O=3Zn(OH)2 +2Fe(OH)3 +4OH”„£»ÓÉĶ¼3ÖŖøßĢśµē³Ų±ČøßÄܼīŠŌµē³Ų·ÅµēŹ±¼ä³¤£¬¹¤×÷µēŃ¹ĪČ¶Ø£»
¹Ź“š°øĪŖ£ŗ3Zn+2FeO42£+8H2O=3Zn(OH)2 +2Fe(OH)3 +4OH”„£»·ÅµēŹ±¼ä³¤£¬¹¤×÷µēŃ¹ĪČ¶Ø£»
æ¼µć£ŗµē½āŌĄķ£»»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ


 ŠĀæĪ±ź½×ĢŻŌĶĮѵĮ·ĻµĮŠ“š°ø
ŠĀæĪ±ź½×ĢŻŌĶĮѵĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ĻĀĶ¼ŹĒŅ»øö»Æѧ¹ż³ĢµÄŹ¾ŅāĶ¼£¬»Ų“šĻĀĮŠĪŹĢā£ŗ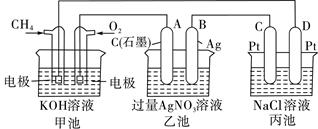
£Ø1£©¼×³ŲŹĒ ×°ÖĆ£¬µē¼«AµÄĆū³ĘŹĒ ”£
£Ø2£©¼××°ÖĆÖŠĶØČėCH4µÄµē¼«·“Ó¦Ź½ĪŖ £¬ŅŅ×°ÖĆÖŠB(Ag)µÄµē¼«·“Ó¦Ź½ĪŖ £¬±ū×°ÖĆÖŠD¼«µÄ²śĪļŹĒ £ØŠ“»ÆѧŹ½£©£¬
£Ø3£©Ņ»¶ĪŹ±¼ä£¬µ±±ū³ŲÖŠ²śÉś112mL£Ø±ź×¼×“æöĻĀ£©ĘųĢåŹ±£¬¾łŌČ½Į°č±ū³Ų£¬ĖłµĆČÜŅŗŌŚ25”ę Ź±µÄpH =__________”££ØŅŃÖŖ£ŗNaClČÜŅŗ×ćĮ棬µē½āŗóČÜŅŗĢå»żĪŖ500 mL£©”£
ČōŅŖŹ¹±ū³Ų»Öø“µē½āĒ°µÄדĢ¬£¬Ó¦Ļņ±ū³ŲÖŠĶØČė £ØŠ“»ÆѧŹ½£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
øÖĢśŗÜČŻŅ×ÉśŠā¶ų±»øÆŹ“£¬ĆæÄźŅņøÆŹ“¶ųĖšŹ§µÄøÖ²ÄÕ¼ŹĄ½ēøÖĢśÄź²śĮæµÄĖÄ·ÖÖ®Ņ»”£
£Ø1£©ĪŖĮĖ½µµĶijĖ®æāµÄĢśÕ¢Ćű»øÆŹ“µÄĖŁĀŹ£¬æÉŅŌ²ÉÓĆĶ¼¼×ĖłŹ¾µÄ·½°ø£¬ĘäÖŠŗø½ÓŌŚĢśÕ¢ĆÅÉĻµÄ¹ĢĢå²ÄĮĻRæÉŅŌ²ÉÓĆ________(Ģī×ÖÄø)”£
| A£®Ķ | B£®ÄĘ |
| C£®Šæ | D£®ŹÆÄ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©ŹĀŹµÖ¤Ć÷£¬ÄÜÉč¼Ę³ÉŌµē³ŲµÄ·“Ó¦Ķس£ŹĒ·ÅČČ·“Ó¦£¬ĻĀĮŠ»Æѧ·“Ó¦ŌŚĄķĀŪÉĻæÉŅŌÉč¼Ę³ÉŌµē³ŲµÄŹĒ ”£(Ģī×ÖÄø)
A£®C(s)+CO2(g)="2CO(g)" ”÷H>0
B£®NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ”÷H<0
C£®2CO(g)+O2(g)=2CO2(1)”÷H<0
£Ø2£©ŅŌKOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬ŅĄ¾Ż£Ø1£©ÖŠĖłŃ”·“Ó¦Éč¼ĘŅ»øöŌµē³Ų£¬ ĘäÕż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ ”£
£Ø3£©ĄūÓĆĻĀĶ¼×°ÖĆ£¬æÉŅŌÄ£ÄāĢśµÄµē»Æѧ·Ą»¤”£ ČōXĪŖĢ¼°ō£¬ĪŖ¼õ»ŗĢśµÄøÆŹ“£¬æŖ¹ŲKÓ¦øĆÖĆÓŚ £ØĢīM»ņÕßN£©“¦£¬“ĖŹ±ČÜŅŗÖŠµÄŅõĄė×ÓĻņ ¼«(ĢīX»ņĢś)ŅĘ¶Æ”£ČōXĪŖŠæ£¬æŖ¹āKÖĆÓŚM“¦£¬øƵē»Æѧ·Ą»¤·Ø³ĘĪŖ£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ijæĪĶāŠĖȤŠ”×éÓĆĻĀĶ¼×°ÖĆ½ųŠŠŹµŃ飬ŹŌ»Ų“š£ŗ
£Ø1£©ČōæŖŹ¼Ź±æŖ¹ŲKÓėaĮ¬½Ó£¬ŌņAµē¼«·“Ó¦Ź½ĪŖ_____________________”£
£Ø2£©ČōæŖŹ¼Ź±æŖ¹ŲKÓėbĮ¬½Ó£¬ÕāÖÖ·½·Ø¾³£ÓĆÓŚ½šŹōµÄ·Ą»¤£¬ÕāÖÖ·Ą»¤“ėŹ©½Š×ö £¬
ŌņBµē¼«·“Ó¦Ź½ĪŖ______________________”£æŖ¹ŲKÓėbĮ¬½Ó£¬ĢśŗĶŹÆÄ«°ō»„»»Ī»ÖĆ¼“æÉÖʵư×É«µÄ½Ļ“æ¾»Fe(OH)2³Įµķ£¬ŌņĢśµē¼«·“Ó¦Ź½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ij³§·ĻĖ®ÖŠŗ¬Į潚ŹōCr3+£Øŗ¬ÓŠÉŁĮæFe3+”¢Cu2+£©”£Ä³ŃŠ¾æŠŌѧĻ°Š”×éĪŖĮĖ±ä·ĻĪŖ±¦£¬½«·ĻĖ®“¦ĄķµĆµ½ÖŲøõĖį¼Ų”£Ä³ŗ¬øõ·ĻĖ®“¦ĄķµÄÖ÷ŅŖĮ÷³ĢČēĶ¼ĖłŹ¾£ŗ
ŅŃÖŖ£ŗ¢Ł ³ĮµķĶźČ«£¬¶ųŌŚpH”Ż3.2Ź±
³ĮµķĶźČ«£¬¶ųŌŚpH”Ż3.2Ź±
Fe£ØOH£©3³ĮµķĶźČ«”£
¢ŚCrO2”Ŗ4ŌŚĖįŠŌ»·¾³ÖŠ·¢Éś£ŗ
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĀĖŌüµÄ³É·ÖŹĒ ”££ØŠ“»ÆѧŹ½£©
£Ø2£©Š“³öµŚ¢Ū²½·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø3£©·ÖĄė³öŗ¬[Cr£ØOH£©4]”ŖµÄČÜŅŗŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠ ”£
£Ø4£©ÄæĒ°Ņ»ÖÖ²ÉÓĆŅŌøõĖį¼ŲĪŖŌĮĻ£¬µē»Æѧ·ØÖʱøÖŲŅŖøõĖį¼ŲµÄŹµŃé×°ÖĆŹ¾ŅāĶ¼ČēĻĀ£ŗ
µē½āŅ»¶ĪŹ±¼äŗ󣬲ā¶ØŃō¼«ŅŗÖŠKŌŖĖŲŗĶCrŌŖĖŲµÄŗ¬Į棬ČōKŌŖĖŲÓėCrŌŖĖŲµÄĪļÖŹµÄĮæÖ®±Č ĪŖd£¬Ōņ“ĖŹ±µÄøõĖį¼ŲµÄ×Ŗ»ÆĀŹĪŖ ”£
ĪŖd£¬Ōņ“ĖŹ±µÄøõĖį¼ŲµÄ×Ŗ»ÆĀŹĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŅŌ»ĘĶæó¾«æóĪŖŌĮĻ£¬ÖĘČ”ĮņĖįĶ¼°½šŹōĶµÄ¹¤ŅÕČēĻĀĖłŹ¾£ŗ
¢ń.½«»ĘĶæó¾«æó£ØÖ÷ŅŖ³É·ÖĪŖCuFeS2£¬ŗ¬ÓŠÉŁĮæCaO”¢MgO”¢Al2O3£©·ŪĖé
¢ņ.²ÉÓĆČēĻĀ×°ÖĆ½ųŠŠµē»Æѧ½ž³öŹµŃé
½«¾«Ń”»ĘĶæó·Ū¼ÓČėµē½ā²ŪŃō¼«Ēų£¬ŗćĖŁ½Į°č£¬Ź¹æó·ŪČܽā”£ŌŚŅõ¼«ĒųĶØČėŃõĘų£¬²¢¼ÓČėÉŁĮæ“߻ƼĮ”£
¢ó.Ņ»¶ĪŹ±¼äŗ󣬳éČ”Ņõ¼«ĒųČÜŅŗ£¬ĻņĘäÖŠ¼ÓČėÓŠ»śŻĶČ”¼Į£ØRH£©·¢Éś·“Ó¦£ŗ
2RH£ØÓŠ»śĻą£©+ Cu2+£ØĖ®Ļą£© R2Cu£ØÓŠ»śĻą£©+ 2H£«£ØĖ®Ļą£©
R2Cu£ØÓŠ»śĻą£©+ 2H£«£ØĖ®Ļą£©
·ÖĄė³öÓŠ»śĻą£¬ĻņĘäÖŠ¼ÓČėŅ»¶ØÅØ¶ČµÄĮņĖį£¬Ź¹Cu2+µĆŅŌŌŁÉś”£
¢ō.µē½āĮņĖįĶČÜŅŗÖĘµĆ½šŹōĶ”£
£Ø1£©»ĘĶæó·Ū¼ÓČėŃō¼«ĒųÓėĮņĖį¼°ĮņĖįĢśÖ÷ŅŖ·¢ÉśŅŌĻĀ·“Ó¦£ŗ
CuFeS2 + 4H£« = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S”ż+ 2H£«
¢Ł Ńō¼«ĒųĮņĖįĢśµÄÖ÷ŅŖ×÷ÓĆŹĒ ”£
¢Ś µē½ā¹ż³ĢÖŠ£¬Ńō¼«ĒųFe3+µÄÅØ¶Č»ł±¾±£³Ö²»±ä£¬ŌŅņŹĒ ”£
£Ø2£©Ņõ¼«Ēų£¬µē¼«ÉĻæŖŹ¼Ź±ÓŠ“óĮæĘųÅŻ²śÉś£¬ŗóÓŠ¹ĢĢåĪö³ö£¬Ņ»¶ĪŹ±¼äŗó¹ĢĢåČܽā”£Š“³öÉĻŹöĻÖĻó¶ŌÓ¦µÄ·“Ó¦Ź½ ”£
£Ø3£©ČōŌŚŹµŃéŹŅ½ųŠŠ²½Öč¢ó£¬·ÖĄėÓŠ»śĻąŗĶĖ®ĻąµÄÖ÷ŅŖŹµŃéŅĒĘ÷ŹĒ £»¼ÓČėÓŠ»śŻĶČ”¼ĮµÄÄæµÄŹĒ ”£
£Ø4£©²½Öč¢ó£¬ĻņÓŠ»śĻąÖŠ¼ÓČėŅ»¶ØÅØ¶ČµÄĮņĖį£¬Cu2+µĆŅŌŌŁÉśµÄŌĄķŹĒ ”£
£Ø5£©²½Öč¢ō£¬Čōµē½ā200mL0.5 mol/LµÄCuSO4ČÜŅŗ£¬Éś³ÉĶ3.2 g£¬“ĖŹ±ČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
A”¢B”¢CČżøöÉÕ±ÖŠ·Ö±šŹ¢ÓŠĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄĻ”ĮņĖį”£
(1) AÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
(2)BÖŠSn¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£Sn¼«ø½½üČÜŅŗµÄc £ØĢī ”°±ä“ó”±”°±äŠ””±»ņ”°²»±ä”±£©”£
£ØĢī ”°±ä“ó”±”°±äŠ””±»ņ”°²»±ä”±£©”£
(3)CÖŠ±»øÆŹ“µÄ½šŹōŹĒ £¬×Ü·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
£¬±Č½ĻA”¢B”¢CÖŠĢś±»øÆŹ“µÄĖŁĀŹ,ÓÉæģµ½ĀżµÄĖ³ŠņĪŖ (ĢīŠņŗÅ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
£Ø15·Ö£©ĪŖĮĖ¼õÉŁĆŗČ¼ÉÕ¶Ō“óĘųŌģ³ÉµÄĪŪČ¾£¬ĆŗµÄĘų»ÆŗĶŅŗ»ÆŹĒøߊ§”¢Ēå½ąĄūÓĆĆŗĢæµÄÖŲŅŖĶ¾¾¶£¬¶ų¼õÉŁCO2ĘųĢåµÄÅÅ·ÅŅ²ŹĒČĖĄąĆęĮŁµÄÖŲ“óæĪĢā”£Ćŗ×ŪŗĻĄūÓƵÄŅ»ÖÖĶ¾¾¶ČēĻĀĖłŹ¾£ŗ
£Ø1£©ÓĆČēĶ¼[£Ø1£©Š”ĢāĶ¼]ĖłŹ¾×°ÖƶØĮæ¼ģ²ā¹ż³Ģ¢Ł²śÉśµÄCO2£ØŅŃÖŖ£ŗĆŗ·ŪČ¼ÉÕ¹ż³ĢÖŠ»į²śÉśSO2£©BÖŠŌ¤ĘŚµÄŹµŃéĻÖĻóŹĒ”””””” £¬DÖŠµÄŹŌ¼ĮŹĒ”””””””” ”£

£Ø2£©ŅŃÖŖ¢Ł C(s) + H2O(g) = CO(g) + H2 (g) £» ¦¤H1 =" +131.3" kJ”¤mol-1
¢Ś C(s) + 2H2O(g) = CO2(g) + 2H2(g)””£»¦¤H2 =" +90" kJ”¤mol-1
””ŌņŅ»Ńõ»ÆĢ¼ÓėĖ®ÕōĘų·“Ӧɜ³É¶žŃõ»ÆĢ¼ŗĶĒāĘųµÄČČ»Æѧ·½³ĢŹ½ŹĒ”””””””””””””””””” ”£
£Ø3£©ÓĆ£Ø3£©Š”ĢāĶ¼×°ÖĆæÉŅŌĶź³É¢ŻµÄ×Ŗ»Æ£¬Ķ¬Ź±ĢįøßÄÜĮæµÄĄūÓĆĀŹ”£Ę䏵ĻÖµÄÄÜĮæ×Ŗ»ÆŠĪŹ½Ö÷ŅŖŹĒÓÉ”””” ””””””ÄÜ×Ŗ»ÆĪŖ ÄÜ£¬aµÄµē¼«·“Ó¦Ź½ŹĒ”””” ”””””””” ”£
£Ø4£©Č¼ĆŗŃĢĘųÖŠµÄCO2æÉÓĆĻ”°±Ė®ĪüŹÕ£¬²»½öæÉŅŌ¼õÉŁCO2µÄÅÅ·Å£¬Ņ²æÉŅŌÉś²ś»Æ·ŹĢ¼ĖįĒāļ§”£¼ŁÉčøĆ·½ ·ØĆ抔Ź±“¦Ąķŗ¬CO2µÄĢå»ż·ÖŹżĪŖ11.2%µÄČ¼ĆŗŃĢĘų 1000 m3(±ź×¼×“æö)£¬ĘäÖŠCO2µÄĶŃ³żŠ§ĀŹĪŖ80%£¬ŌņĄķĀŪÉĻĆ抔Ź±Éś²śĢ¼ĖįĒāļ§”” ””””kg”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com